Holmio

- 3925
- 920
- Prof Ines Gaillard
 Échantillon HOLM Ultrapure métallique. Source: Images haute résolution d'éléments chimiques [CC par 3.0 (https: // CreativeCommons.Org / licences / par / 3.0)]
Échantillon HOLM Ultrapure métallique. Source: Images haute résolution d'éléments chimiques [CC par 3.0 (https: // CreativeCommons.Org / licences / par / 3.0)] Qu'est-ce que le Holmio?
Il Holmio C'est un élément métallique appartenant au bloc F du tableau périodique, spécifiquement à la période des lantanides. Il est donc membre des Rare Earths, à côté d'Erbio, Itrio, Disposio et Iterbio. Tous ces éléments constituent une série de minéraux (Xenotima ou Gadolinita) qui sont difficiles à séparer par des méthodes chimiques conventionnelles.
Son symbole chimique est le HO, ayant un nombre atomique de 67, et moins abondant que ses voisins Disposio (66Dy) et erbio (68Er). On dit alors que la règle d'Oddo-Harkins obéit. Holmius est l'un de ces métaux rares que presque personne ne connaît ou soupçonne son existence; Même parmi les produits chimiques, il n'est généralement pas mentionné très fréquemment.
Dans les domaines de la médecine, Holmio est connu pour l'utilisation de son laser dans les chirurgies pour lutter contre les pathologies de la prostate. Il représente également le matériau prometteur pour la fabrication d'électromagnes et d'ordinateurs quantiques, en raison de ses propriétés magnétiques inhabituelles.
Composés de l'Holmium, trivalent, ho3+, Ils présentent la particularité de la présentation d'une couleur dépendante de la lumière avec laquelle ils sont irradie. Si cela est fluorescent, la couleur de ces composés passe du jaune au rose. De même, cela se produit avec ses solutions.
Histoire
La découverte du Holmio est attribuée à deux produits chimiques suisses, Marc Defontaine et Jacques-Louis Soret, qui en 1878 a été détecté spectroscopique lors de l'analyse dans les minéraux de Genève de terres rares. Ils l'ont appelé élément x.
Un an plus tard, en 1879, le chimiste suédois par Teodor Cleve a géré2SOIT3). Cet oxyde, contaminé par d'autres impuretés, a montré une coloration brune, qu'il a nommée «Holmia», ce qui signifie un accident vasculaire cérébral en latin.
Peut vous servir: réaction exergonique: caractéristiques et exemplesDe plus, Cleve a obtenu un autre matériau vert: «Thulia», qui devient l'oxyde de tuo. Le problème de cette découverte est qu'aucun des trois produits chimiques ne pouvait obtenir un échantillon suffisant pur de l'oxyde de Holm, car il a été contaminé par des atomes de docch, un autre lanthanure de métal.
Ce n'était rien d'autre que en 1886 que le produit chimique français, Paul Lecoq de Boisbaudran, a isolé l'oxyde de Holm par des précipitations fractionnées. Cet oxyde a ensuite subi des réactions chimiques pour produire des sels Holmio, qui ont été réduits en 1911 par le chimiste suédois Otto Holmberg; Et donc, les premiers échantillons Holm métalliques sont apparus.
Cependant, actuellement les ions Holmio, Hol3+, Ils sont extraits par chromatographie d'échange d'ions, au lieu de recourir à des réactions conventionnelles.
Propriétés Holm
 Holmio Emplacement dans le tableau périodique. Source: Vectorisation: Sushant Savla 05:51, 9 juin 2019 (UTC), CC BY-SA 4.0, via Wikimedia Commons
Holmio Emplacement dans le tableau périodique. Source: Vectorisation: Sushant Savla 05:51, 9 juin 2019 (UTC), CC BY-SA 4.0, via Wikimedia Commons Apparence physique
Métal argenté, doux, ductile et malléable.
Numéro atomique
67 (67Ho)
Masse molaire
164,93 g / mol
Point de fusion
1461 ºC
Point d'ébullition
2600 ºC
Densité
À température ambiante: 8,79 g / cm3
Juste au moment de fondre ou de fondre: 8,34 g / cm3
Chaleur de fusion
17 kJ / mol
Chaleur de vaporisation
251 kJ / mol
Capacité thermique molaire
27.15 J / (mol · k)
Électronégativité
1.23 sur l'échelle Pauling
Énergies d'ionisation
Premièrement: 581,0 kJ / mol (Ho+ gazeux)
Deuxième: 1140 kJ / mol (HO2+ gazeux)
Troisième: 2204 kJ / mol (HO3+ gazeux)
Conductivité thermique
16.2 w / (m · k)
Résistivité électrique
814 nΩ · m
Nombres d'oxydation
Le HOLM peut être présenté dans ses composés avec les nombres ou états d'oxydation suivants: 0, +1 (HO+), +2 (ho2+) et +3 (ho3+). De tous, +3 est de loin le plus courant et le plus stable. Par conséquent, le HOLM est un métal trivalent, formant des composés (ioniques ou partiellement ioniques) où il participe comme un ho ion3+.
Peut vous servir: acétate d'éthylePar exemple, dans les composés suivants, le HOLM se trouve avec un numéro d'oxydation +3: HO2SOIT3 (Ho23+SOIT32-), Ho (oh)3, Hoi3 (Ho3+Toi3-) et ho2(SW4)3.
Le ho3+ Et ses transitions électroniques sont responsables des composés de ce look métallique jaune brun. Cependant, lorsqu'ils rayonnent avec une lumière fluorescente, ils deviennent roses. Il en va de même pour leurs solutions.
Isotopes
Holmio est présenté dans la nature comme un seul isotope stable: 165Ho (100% abondance). Cependant, il y a des radio-isotopes artificiels avec des temps de demi-vie considérables. Entre eux nous avons:
-163Ho (t1/2 = 4570 ans)
-164Ho (t1/2 = 29 minutes)
-166Ho (t1/2 = 26 763 heures)
-167Ho (t1/2 = 3,1 heures)
Ordre magnétique et moment
Le HOLM est un métal paramagnétique, mais il peut devenir ferromagnétique à une température de 19 K, présentant des propriétés magnétiques très fortes. Il est caractérisé par le moment magnétique (10,6 μB) plus grand parmi tous les éléments chimiques, ainsi qu'une perméabilité magnétique inhabituelle.
Réactivité
Le Holm est un métal qui, dans des conditions normales, ne s'oppose pas trop rapidement, il faut donc perdre sa luminosité. Cependant, lorsqu'il est chauffé avec un briquet, il devient jaunâtre, le produit de la formation d'une couche d'oxyde:
4 ho + 3 o2 → 2 ho2SOIT3
Réagit avec les acides dilués ou concentrés pour provoquer leurs sels respectifs (nitrates, sulfates, etc.). Cependant et de manière surprenante, il ne réagit pas avec l'acide fluorhorique, car une couche HOF3 le protège de sa dégradation.
Le Holmio réagit également avec tous les halogènes pour produire leurs halogénuros respectifs (HOF3, Hocl3, Hobr3 et hoi3).
Structure chimique
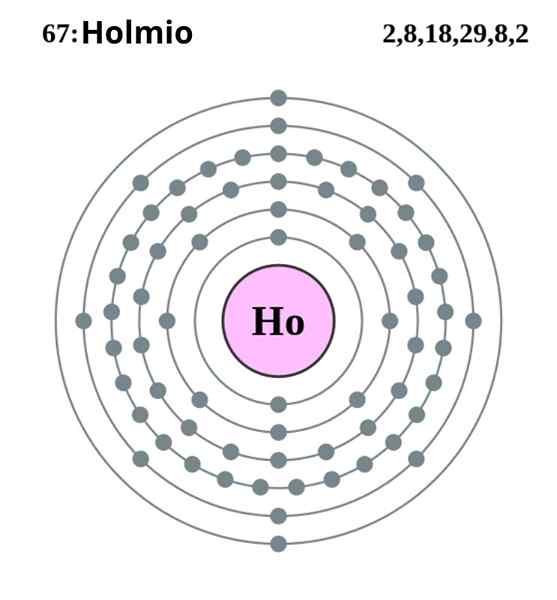 Configuration électronique Holmio. Source: Pumba (travail original de Greg Robson) Creative Commons Reconntion-share sous la même licence 2.0 Angleterre et pays du Pays de Galles
Configuration électronique Holmio. Source: Pumba (travail original de Greg Robson) Creative Commons Reconntion-share sous la même licence 2.0 Angleterre et pays du Pays de Galles Le Holmio se cristallise dans une structure hexagonale compacte, HCP (pour son acronyme en anglais: hexagonal fermement emballé). En théorie, les atomes HO restent cohésifs grâce à la liaison métallique formée par les électrons de leurs orbitales 4F, selon leur configuration électronique:
Peut vous servir: dilution: concept, comment il se fait, des exemples, des exercices[XE] 4Fonze 6s2
De telles interactions, ainsi que le système énergétique de ses électrons, définissent les propriétés physiques du Holmio. Ce métal n'est connu aucun autre alotrope ou polymorphe, pas même sous des pressions élevées.
Applications
Réactions nucléaires
L'atome Holmio est un bon absorbant à neutrons, il aide donc à contrôler le développement des réactions nucléaires.
Spectroscopie
Les solutions d'oxyde Holmio sont utilisées pour calibrer les spectrophotomètres, car leur spectre d'absorption reste presque toujours, quelles que soient les impuretés qu'il contient. Il montre également des bandes aiguës très caractéristiques associées à l'atome Holmio, et non à ses composés.
Colorant
Les atomes de Holmio sont capables de fournir des colorations rougeâtres au verre et aux joyaux artificiels de circonsites cubiques.
Aimants
À des températures extrêmement basses (30 K ou moins), le Holmius présente des propriétés magnétiques intéressantes, qui sont utilisées pour fabriquer des électromas puissants, où il aide à concentrer le champ magnétique résultant.
Ces matériaux magnétiques sont destinés à la résonance magnétique nucléaire; pour le développement de disques durs, avec des souvenirs qui oscillent dans l'ordre des pétaoctets ou des téraoctets; et éventuellement fabriquer des ordinateurs quantiques.
Laser Holmio
Un cristal de grenat ititrio-aluminium (YAG) peut être dopant avec des atomes holmio pour émettre un rayonnement dont la longueur d'onde est de 2 μm; C'est-à-dire que nous avons un laser Holm. Grâce à lui, les tissus tumoraux peuvent être coupés précisément sans provoquer de saignement, car l'énergie fournie fait immédiatement les blessures.
Ce laser a été utilisé de manière récurrente dans les chirurgies de la prostate et dentaire, ainsi que pour éliminer les cellules cancéreuses et les calculs rénaux.

