Hypochlorite de sodium (naclo)
- 2923
- 430
- Louna Baron
Nous expliquons ce qu'est l'hypochlorite de sodium, ses propriétés, sa synthèse et ses applications
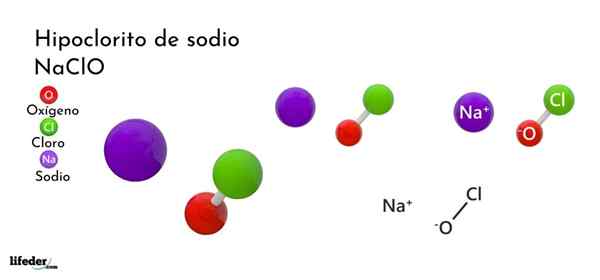
 Formule et structure de l'hypochlorite de sodium
Formule et structure de l'hypochlorite de sodium Qu'est-ce que l'hypochlorite de sodium?
Il l'hypochlorite de sodium (Naclo) est un sel ternaire et inorganique de sodium. Commercialement il est réalisé sous forme de solutions aqueuses et est l'agent actif de ces produits domestiques et industriels. Ces solutions sont connues avec les noms de chlore blanc, de soude plus blanc, de liquide plus blanc ou, encore plus raffiné, d'alcool de javel.
Dans l'eau, l'hypochlorite de sodium présente les mêmes propriétés oxydantes du chlore gazeux, donc une solution de ce sel équivaut à transporter ledit composé à l'intérieur d'une bouteille en plastique. En fait, le chlore disponible dans ces conteneurs est un indicateur de la concentration et de la puissance de blanchiment de la solution d'hypochlorite de sodium.
Ce sel ternaire dans l'eau peut bien être considéré comme une simple solution aqueuse de chlore; Cependant, il existe également d'autres formulaires disponibles, tels que solides dans le cas de l'hypochlorite de calcium et le chlore liquide. Les trois ont le même pouvoir oxydant et leurs utilisations dépendent de variables telles que le confort, les performances ou le temps.
Formule
La formule chimique de l'hypochlorite de sodium est naclo. Est composé d'un na cation+ Et un anion Clo-. Na ions+ Ils ressentent une attraction électrostatique pour les ions CLO-, Ce dernier adoptant une structure tétraédrique avec une hybridation SP3.
La formule indique la proportion d'ions dans l'état d'anhydride, qui est égal à 1: 1. Cependant, il ne s'applique que pour l'anhydride.
Dans le cas de l'hypochlorite de sodium hydraté - L'une des formes les plus stables pour cette formule chimique sel est naclo · 5h2SOIT.
Où est l'hypochlorite de sodium?
Naclo est un produit synthétique et, en raison de sa réactivité, il ne se trouve que dans les régions locales où elle est utilisée, en particulier dans les eaux usées, les sols ou même dans les émanations d'eau potable.
Dans le corps humain abondent les ions de chlorure, qui pourraient participer à des réactions redox qui produisent de l'hypochlorite de sodium au sein de l'organisme.
Peut vous servir: oxydes métalliquesLa synthèse
Tout au long de l'histoire, Naclo a été préparé pour plusieurs méthodes. Le plus simple consiste en une solution de chlore dans l'eau ou des solutions NA2CO3 cette version co2 Par action de l'acide hypochlouleux (HCLO).
D'autres méthodes utilisent la saumure de mer comme matière première à travers un processus électrolytique. Sous une agitation mécanique efficace, le Cl2 et le NaOH généré par le NaCl et l'eau réagissent et deviennent naclo:
CL2(g) + 2naoh (aq) => naclo + nacl + h2O + Q (chaleur)
Aujourd'hui, le processus de pute fabrique ce composé à grande échelle, qui consiste en une version améliorée de la méthode précédente décrite.
Utilisations / applications de chlorite de sodium
 L'une des principales applications de l'hypochlorite de sodium est de blanchir les vêtements
L'une des principales applications de l'hypochlorite de sodium est de blanchir les vêtements Les applications d'hypochlorite de sodium les plus courantes sont:
- L'hypochlorite de sodium est utilisé comme agent de blanchiment dans les textiles, dans les détergents qui l'incorporent et dans l'industrie du papier.
- Son utilisation comme agent bactéricide et désinfectant est très large, en utilisant la purification de l'eau et le traitement des eaux usées.
- Son utilité dans la désinfection de l'équipement utilisé dans la préparation des aliments et la transformation des fruits et légumes est connu. Il est également utilisé avec la même fonction désinfectante dans la production de champignons, de bovins, de porcs et de volaille.
- L'hypochlorite de sodium est utilisé dans l'industrie pétrolière au stade de raffinage.
- Dans la maison, la capacité de blanchiment de l'hypochlorite de sodium est utilisée dans le lavage des vêtements blancs et l'action désinfectante dans les bains de nettoyage, les planchers, etc.
- L'hypochlorite de sodium est utilisé en thérapie endodontique, en particulier dans le traitement de la racine dentaire. Ce traitement utilise la solution Dakin (clone à 0,5%) qui préserve le tissu dentaire vital lors de la dissolution du tissu nécrotique.
Propriétés d'hypochlorite de sodium
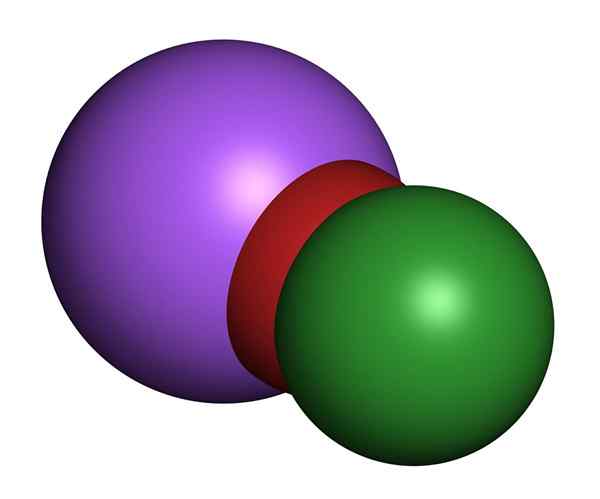 Modèle d'hypochlorite de sodium 3D. Chlore (vert), oxygène (rouge), sodium (violet)
Modèle d'hypochlorite de sodium 3D. Chlore (vert), oxygène (rouge), sodium (violet) Les solutions d'hypochlorite de sodium à température ambiante sont incolores et ont une odeur de chlore sucrée. Les propriétés physiques varient en fonction des concentrations de sel dissoutes dans l'eau. Tous ont des colorations jaunes.
Grâce aux techniques de cristallisation, ces solutions obtiennent le naclo solide · 5H2Ou, dont les cristaux sont en vert.
Ce sel hydraté a un poids moléculaire approximatif de 164 g / mol, une densité de 1,11 g / ml, est très soluble dans l'eau et se décompose à 101 ºC. Le naclo · 5h2Ou est également sensible aux mêmes réactions d'anhydride.
Pourquoi le sel Pentahydrate est-il? Alors que le naclo se cristallise dans son environnement aqueux, les molécules d'eau enveloppent les ions dans une sphère aqueuse.
On peut penser que trois de ces molécules interagissent avec les paires d'électrons non partagées du Cl: une forme de pont hydrogène avec l'O et le dernier est attiré par le na.
Cependant, ce sont les études axées sur la structure cristalline de ce solide qui a la vraie réponse à cette question.
Équilibre aqueux
L'anion Clo- Participer à l'équilibre hydrolyse suivant:
Hclo (ac) + h2Ou (l) CLO-(AC) + H+(AC)
Si l'acidité de la solution augmente, l'équilibre se déplace vers la gauche, produisant HCLO.
Cet acide est encore plus instable que l'hypochlorite et, par conséquent, la décomposition diminue la concentration de l'agent actif. Si le pH est basique (supérieur à 11), il garantit l'existence du CLO- et la durée de vie du produit.
Cependant, l'alcalinité excessive déclenche d'autres problèmes dans ses applications. Par exemple, une solution de naillo très basique endommage les vêtements au lieu de simplement le blanchir.
De plus, en milieu aqueux, le HCLO est également transformé en chlore, ce qui explique les colorations jaunes de ces solutions:
Peut vous servir: concentration en pourcentageHCLO (AC) CL2(g) + h2Ou (l)
Disproportion
L'atome de chlore dans l'hypochlorite de sodium a un état d'oxydation de +1, ne nécessitant que deux électrons pour compléter son octet de Valence.
D'un autre côté, sa configuration électronique est [NE] 3S23p5, Pouvoir vider tous les électrons de leurs orbitales "P", plus d'énergie.
Il en résulte que l'hypochlorite souffre de réactions de disproportion sur des ions avec des états d'oxydation de +1 et +5:
3Cl-(Ac) 2Cl-(AC) + CLO3-(AC)
Cette réaction en solution aqueuse est accélérée avec les augmentations de température et les concentrations d'hypochlorite. De même, la réaction se poursuit par un mécanisme différent catalysé par la lumière et les oxydes métalliques du cuivre, du nickel et du cobalt:
2NAOCl (aq) => o2(g) + 2NACl (aq)
L'anhydride nemento est disproportionné à une vitesse beaucoup plus rapide, même en explosant.
Agent d'oxydation
L'atome de chlore peut accepter les électrons d'espèces négatives (nucléophile). L'anhydride est un puissant agent oxydant, réduisant les anions chlorure (CL-).
Dans le cas de Naclo · 5H2Ou, on pense que les molécules d'eau empêchent en partie le CLO- Ils souffrent d'attaques nucléophiles.
Cependant, étant donné la linéarité structurelle du CLO-, Ces molécules d'eau ne ralentissent pas suffisamment de "attaques" sur l'atome de Cl. C'est pour cette raison que l'hypochlorite de sodium est un agent oxydant fort.
Les références
- Wikipédia. (2018). L'hypochlorite de sodium. Récupéré le 7 avril 2018 de: dans.Wikipédia.org
- Francisco J. Arnaiz. (2016). Expériences pour le Laboratoire de chimie inorganique vert. Département de chimie, Université de Burgos, Espagne.
- Livre chimique. (2017). L'hypochlorite de sodium. Récupéré le 7 avril 2018 de: ChemicalBook.com
- Brian Clegg. (9 mars 2016). L'hypochlorite de sodium. Récupéré le 7 avril 2018 de: Chemistryworld.com
- Oxychem. (Décembre 2014). Manuel d'hypochlorite de sodium. Récupéré le 7 avril 2018 de: Oxy.com
- Se publier. (2018). L'hypochlorite de sodium. Récupéré le 7 avril 2018 de: PubChem.NCBI.NLM.NIH.Gouvernement.

