Structure d'hydroxyde de magnésium, propriétés, nomenclature, utilisations

- 3641
- 699
- Eva Henry
Il l'hydroxyde de magnésium C'est un composé inorganique dont la formule chimique est Mg (OH)2. Dans sa forme pure, il est un solide blanc sans luminosité et apparence amorphe; Cependant, avec un petit contenu précis des impuretés, il est transformé en brucita solide cristallin, un minéral qui est dans certains dépôts dans la nature, et est une riche source de magnésium.
C'est un électrolyte ou une base faible, donc sa dissociation est faible en eau. Cette propriété fait le MG (OH)2 un bon neutralisant d'acidité pour la consommation humaine; Remède populairement connue comme la suspension du lait de la magnésie. C'est aussi un ignifuge en libérant de l'eau pendant sa décomposition thermique.
 Échantillon d'hydroxyde de magnésium solide. Source: Chemical Intestrest [Domaine public]
Échantillon d'hydroxyde de magnésium solide. Source: Chemical Intestrest [Domaine public] Dans l'image supérieure, certains solides d'hydroxyde de magnésium sont représentés, dans lesquels sa couleur blanche opaque peut être vue. Plus ils sont cristallins, ils développent des surfaces vitreuses et perlées.
Sa structure cristalline est particulière car elle établit des cristaux hexagonaux à double couche, qui sont des conceptions prometteuses pour la conception de nouveaux matériaux. Dans ces couches, leurs charges positives jouent un rôle important en raison du remplacement du MG2+ par des cations trivalents, et à l'espèce confinée entre les murs composés d'anions oh-.
D'un autre côté, d'autres applications dérivent en fonction de la morphologie des particules ou des nanoparticules préparées; comme catalyseurs ou adsorbants. Dans chacun d'eux, le rapport 1: 2 pour les ions Mg est constant2+: Oh-, reflété dans la même formule MG (OH)2.
[TOC]
Structure
Formule et octaedro
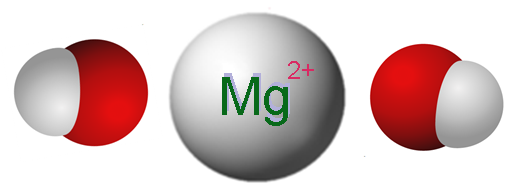 Ions qui composent l'hydroxyde de magnésium. Source: Claudio Pistilli [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)]
Ions qui composent l'hydroxyde de magnésium. Source: Claudio Pistilli [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)] L'image supérieure montre les ions qui composent le Mg (OH)2. Comme on peut le voir, il y a deux anions oh- Pour chaque cation mg2+, qui interagissent électrostatiquement pour définir un cristal de structure hexagonale. La même formule indique que le rapport Mg: OH est 1: 2.
Cependant, la vraie structure cristalline est un peu plus complexe que de supposer des ions Mg simples2+ et oh-. En fait, le magnésium est caractérisé par un nombre de coordination de 6, il peut donc interagir avec jusqu'à six oh-.
Ainsi, l'octaèdre Mg (OH) est formé6, où les atomes d'oxygène viennent évidemment de l'OH-; Et la structure cristalline repose désormais sur la considération de ces octaèdres et comment ils interagissent les uns avec les autres.
En fait, des unités Mg (OH)6 Ils finissent par définir des structures à double couche qui, à leur tour, sont ordonnées dans l'espace pour provoquer le verre hexagonal.
Peut vous servir: poids atomiqueCouche double
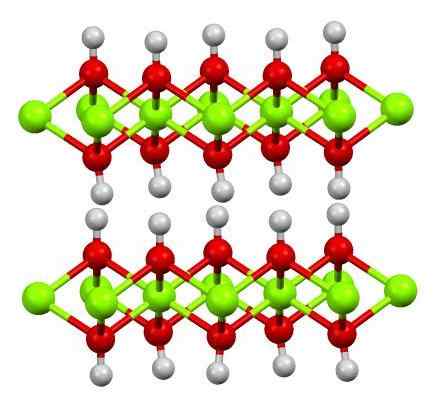 Double couche d'hydroxyde de magnésium. Source: Smokefoot [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)]
Double couche d'hydroxyde de magnésium. Source: Smokefoot [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)] L'image supérieure montre la double couche d'hydroxyde de magnésium (LDH) Hydroxydes doubles en couches). Les sphères vertes représentent les ions Mg2+, qui pourrait être remplacé par d'autres de charge plus grande pour générer une charge positive dans la couche.
Notez que autour de chaque mg2+ Il y a six sphères rouges liées à leurs sphères blanches respectives; c'est-à-dire les unités octaédriques mg (OH)6. OH- Il agit comme un pont pour rejoindre deux mg2+ de différents plans, ce qui fait que les couches sont confinées.
De même, il est observé que les atomes d'hydrogène pointent de haut en bas et sont les premiers responsables des forces intermoléculaires pour maintenir les deux couches d'unités Mg (OH)6.
Parmi ces couches, des molécules neutres (comme les alcools, l'ammoniac et l'azote) ou même les anions, selon leur positif (s'il y a des ions3+ ou la foi3+ Remplacement du MG2+). La «garniture» de ces espèces est confinée par les surfaces composées d'anions OH-.
Morphologies
Le verre hexagonal et à double couche pousse lentement ou rapidement. Tout dépend de la synthèse ou des paramètres de préparation: température, relation molaire, agitation, solvants, réactifs comme source de magnésium, bases ou agents précipités, etc. À mesure que le verre se développe, définissez la microstructure ou la morphologie de ses nanoparticules ou agrégats.
Ainsi, ces nanoparticules peuvent avoir des plats, des plaquettes ou du chou-fleur. De même, la distribution de ses tailles peut changer, ainsi que le degré de porosité des solides résultants.
Propriétés
Apparence physique
C'est un solide blanc, granulé ou en poudre et les toilettes.
Masse molaire
58 3197 g / mol.
Densité
3,47 g / ml.
Point de fusion
350 ºC. À cette température, il se décompose dans l'oxyde en libérant les molécules d'eau contenues dans leurs cristaux:
Mg (oh)2(s) => mgo (s) + h2O (g)
Solubilité dans l'eau
0,004 g / 100 ml à 100 ° C; C'est-à-dire qu'il parvient à peine à se dissoudre dans l'eau bouillante, c'est donc un composé insoluble dans l'eau. Cependant, en diminuant le pH (ou l'augmentation de l'acidité), sa solubilité est augmentée par la formation de l'Acuo complexe, Mg (OH2)6.
D'un autre côté, si le Mg (OH)2 a absorbé CO2, libérera le gaz conservé comme effervescence lors de la dissolution dans un milieu acide.
Peut vous servir: Hélium: histoire, propriétés, structure, risques, utilisationsIndice de réfraction
1 559
pH
Une suspension aqueuse a un pH qui varie entre 9,5 et 10,5. Bien que ces valeurs soient normales, elle reflète sa petite basicité contre d'autres hydroxydes métalliques (comme NaOH).
Capacité thermique
77.03 j / mol · k
Où est-il situé?
 Blut Brucita Blue Blut. Source: Rob Lavinsky, Irocks.com-cc-by-sa-3.0 [cc by-sa 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]
Blut Brucita Blue Blut. Source: Rob Lavinsky, Irocks.com-cc-by-sa-3.0 [cc by-sa 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)] L'hydroxyde de magnésium peut être trouvé dans la nature comme le minéral de Brucita, qui se caractérise par sa couleur blanche transparente, avec des tons verts ou bleuâtre en fonction de ses impuretés. De même, la Brucita fait partie de certaines argiles, comme le chlorite, lorsqu'elle entre les couches de silicates, rejointes par des ions métalliques.
À La Brucita, il y a d'autres ions en plus de Mg2+, Comme Al3+, Foi3+, Zn2+ et MN2+. Leurs Menas peuvent être trouvés dans différentes régions ou lacs d'Écosse, du Canada, d'Italie et des États-Unis.
Physiquement, leurs cristaux voient.
Ce minéral est l'un des maux qui affectent les ciments et le béton, car il a tendance à se développer et à provoquer des fractures. Cependant, il n'absorbe pas le CO2, Sa calcination ne contribue donc pas à l'effet de serre et, par conséquent, c'est une source minéralogique appropriée (et la plus riche) pour obtenir du magnésium, en plus de l'eau de mer.
Nomenclature
Le Mg (OH)2 Il a jusqu'à trois noms acceptés par l'IUPAC (hors de minéralogie ou de médecine). Celles-ci sont très similaires les unes aux autres, car juste la façon dont ils se terminent.
Par exemple, «l'hydroxyde de magnésium» correspond à son nom en fonction de la nomenclature des stocks, omettant le (ii) à la fin parce que le +2 est presque par défaut le seul état d'oxydation du magnésium.
«Dihydroxyde de magnésium», pointant avec le préfixe du numérateur grec le nombre d'ions OH- indiqué dans la formule selon la nomenclature systématique. Et «l'hydroxyde magnétique», se terminant par le suffixe -ico pour être l'état maximum et «unique» d'oxydation du magnésium, selon la nomenclature traditionnelle.
Les autres noms, tels que le lait Brucita ou la magnésie, bien qu'ils soient directement liés à ce composé, il n'est pas commode d'y faire référence en ce qui concerne son solide le plus pur, ou en tant que composé inorganique (réactif, matière première, etc.).
Applications
Neutraliser
Le Mg (OH)2 En raison de sa faible solubilité dans l'eau, le fait qu'il s'agit d'un excellent neutralisant d'acidité; Sinon, le milieu baserait lorsqu'il contribuerait à de grandes concentrations d'ions OH-, Comme d'autres bases (électrolytes forts).
Peut vous servir: hybridation chimiqueAinsi, le Mg (OH)2 libérer à peine oh-, En même temps, il réagit avec les ions h3SOIT+ Pour former le complexe de magnésium, également mentionné ci-dessus. Pouvant de neutraliser l'acidité des milieux aqueux, il est destiné au traitement des eaux usées.
Il s'agit également d'un additif de nourriture, d'engrais et de certains produits d'hygiène personnelle, comme le dentifrice, car son acidité diminue.
Antiacide
Étant peu soluble dans l'eau, il peut être pris sans courir le risque des effets de ses ions OH- (très peu de dissociation comme un électrolyte faible).
Cette caractéristique, liée à la sous-partie par le haut, en fait un antiacide pour traiter l'acidité de l'estomac, les maladies gastro-intestinales, l'indigestion et la constipation, vendues sous la formule du lait de magnésie.
D'un autre côté, le lait de magnésie aide également à lutter contre les faciès ennuyeux (les plaies blanches et rouges qui apparaissent dans la bouche).
Retardateur de flamme
Dans la section des propriétés, il a été mentionné que le MG (OH)2 Il décompose en libérant de l'eau. Précisément, une telle eau aide à arrêter la progression des flammes, car elles absorbent la chaleur pour se vaporiser et, à leur tour, les vapeurs diluent les gaz combustibles ou inflammables.
Le minéral Brucita est généralement utilisé industriellement à cette fin, conçu comme remplissant certains matériaux, tels que les plastiques de différents polymères (PVC, résines, caoutchoucs), câbles ou plafonds.
Catalyseur
Le Mg (OH)2 synthétisé comme des nanoplaquetas s'est avéré efficace pour catalyser les réductions chimiques; Par exemple, le 4-nitrofénol (PH-NO2) Un 4-aminophénol (PH-NH2). Ils ont également une activité antibactérienne, il pourrait donc être utilisé comme agent thérapeutique.
Adsorbant
Quelques solides mg (oh)2 Ils peuvent être assez poreux, selon la méthode de leur préparation. Par conséquent, ils trouvent l'application comme des adsorbants.
Dans les solutions aqueuses, ils peuvent adsorber (sur leurs surfaces) les molécules de coloration, clarifiant l'eau. Par exemple, ils sont capables d'adsorber le colorant de carmin indigo présent dans les courants d'eau.
Les références
- Fhiver & Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Wikipédia. (2019). Hydroxyde de magnésium. Récupéré de: dans.Wikipédia.org
- Centre national d'information sur la biotechnologie. (2019). Hydroxyde de magnésium. Base de données PubChem. CID = 14791. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement
- Galeries d'améthyste. (2014). La brucite minérale. Récupéré de: galeries.com
- Henrist et al. (2003). Étude morphologique des nanoparticules d'hydroxyde de magnésium
- Prépifié en solution aqueuse diluée. Journal of Crystal Growth 249, 321-330.
- Saba J., Shanza R. K., Muhammad r. S. (2018). Synthèse et analyse structurelle des nanoparticules d'hydroxyde de magnésium mésoporeux comme catalyseur efficace.
- Thimmasandra Narayan Ramesh et Vani Pavada Sreenivasa. (2015). Élimination du colorant à carmin indigo de la solution aqueuse en utilisant l'hydroxyde de magnésium comme adsorbant. Journal of Materials, Vol. 2015, article ID 753057, 10 pages. est ce que je.org / 10.1155/2015/753057
- « Historique, propriétés, structure, utilisations, risques
- Carlos Pellicer Chamber Biographie, style, œuvres, phrases »

