Structure d'hydroxyde de chrome, propriétés, synthèse, utilisations
- 1370
- 381
- Anaïs Julien
Il Hydroxyde de chrome Il s'agit d'un produit composé inorganique de la réaction d'une base avec un sel chromé. Sa formule chimique varie en fonction du statut d'oxydation chromée (+2 ou +3, pour ce type de composé). Ayant ainsi Cr (OH)2 Pour l'hydroxyde de chrome (II) et CR (OH)3 Pour l'hydroxyde de chrome (III).
Pour des raisons électroniques, le CR2+ est plus instable que le CR3+, SO CR (OH)2 C'est un agent réducteur (perd un électron pour passer à +3). Ainsi, bien que les deux hydroxydes puissent être obtenus sous forme de précipités, le Cr (OH)3 -Également appelé hydroxyde chromique - est le composé prédominant.
 Apparence d'hydroxyde de chrome
Apparence d'hydroxyde de chrome Contrairement aux hydroxydes obtenus par la dissolution simple des oxydes métalliques dans l'eau, CR (OH)3 Il n'est pas synthétisé par cette voie en raison de la mauvaise solubilité de l'oxyde chromique (Cr2SOIT3, image supérieure). Cependant, CR (OH)3 Il est considéré comme le CR2SOIT3· XH2Ou, utilisé comme pigment vert émeraude (Guinet Green).
En laboratoire, il est basé sur le chrome métallique, qui est dissous en solution acide pour la formation du complexe [CR (OH2)6]]3+. Ce complexe aqueux réagit ensuite avec une base (NaOH ou KOH) pour former l'hydroxyde chromique correspondant.
Si les étapes précédentes sont effectuées dans des conditions qui garantissent l'absence d'oxygène, la réaction provient de Cr (OH)2 (Hydroxyde chromous). Par la suite, une séparation et une déshydratation du solide précipité sont nécessaires. En conséquence, le vrai CR (OH) est "né"3, Une poudre verte avec une structure polymère et incertaine.
[TOC]
Structure d'hydroxyde de chrome
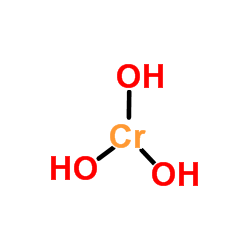
L'image supérieure est la représentation la plus simple de Cr (OH)3 en gaz et phase isolée. Et en supposant également le caractère purement ionique de ses interactions, dans les cations solides, peut être visualisée3+ Interagir avec une quantité en triple d'anions OH-.
Peut vous servir: absorbant molaireCependant, la nature de la liaison CR-OH est plus covalente, en raison de la chimie de la coordination CR3+.
Par exemple, le complexe [CR (oh2)6]]3+ Il indique que le centre chromé métallique est coordonné avec six molécules d'eau; Comme ceux-ci sont neutres, le complexe présente la charge positive du cation original, CR3+.
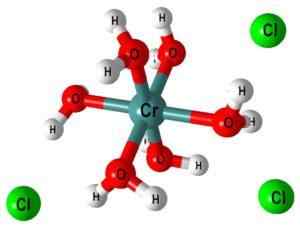
Octaèdre et polymérisation
Dans l'image supérieure, la structure du complexe [CR (OH est représentée2)6]]3+. Clôture- Ils peuvent venir, par exemple, de l'acide chlorhydrique dans le cas où il a été utilisé pour la dissolution du sel ou de l'oxyde chromique.
Lorsque NaOH (ou KOH) est ajouté au milieu de réaction, l'ion oh- Us une molécule de ce complexe, formant [CR (OH2)5(Oh)]2+ (Maintenant, il y a cinq molécules d'eau parce que le sixième a perdu un proton).
Par conséquent, ce nouveau complexe déshydraté dans un autre complexe aqueux, créant des dímeros unis par des ponts d'hydroxyde:
(H2SOIT)5Cr-oh-cr (oh2)5
À mesure que la basicité du milieu augmente (le pH monte) le complexe [Cr (OH2)4(OH)2]]+, et augmenter également les probabilités de nouveaux ponts d'hydroxyde pour créer. En fait, cette "gelée gris-gree" refuse de précipiter ordonné.
Enfin, CR (oh2)3(OH)3 Il se compose d'un octaèdre avec le CR3+ Au centre, et lié à trois molécules d'eau et à trois oh- qui neutralisent leur charge positive; Ceci sans considérer la polymérisation.
Quand le CR (oh2)3(OH)3 Il est déshydraté, l'eau coordonnée avec le CR est éliminée3+, Et comme ce cation est coordonné avec six espèces (ligands), des structures polymères surviennent dans lesquelles des liaisons CR-Cr sont impliquées.
Peut vous servir: graisse butyrique: Obtention, types, composition, utilisations, avantagesDe plus, lorsqu'il est déshydraté, sa structure peut être considérée comme un type CR2SOIT3· 3h2SOIT; En d'autres termes, celui de l'oxyde chromique tri-hydraté. Cependant, ce sont les études physicochimiques du solide qui peuvent faire la lumière sur la véritable structure de Cr (OH)3 à ce stade.
Propriétés physiques et chimiques de l'hydroxyde de chrome
CR (OH)3 Il ressemble à une poudre bleu-vert, mais quand il entre en contact avec de l'eau pour qu'il forme une gelée verte grisâtre.
Il est insoluble dans l'eau, mais soluble dans les acides et les bases fortes. De plus, lorsqu'il est chauffé, il se décompose, produisant des vapeurs d'oxyde de chrome.
Anfotérisme
Pourquoi l'hydroxyde de chrome est-il soluble dans l'acide et les solutions de base? La raison est due à son caractère amphoter, qui vous permet de réagir avec les acides et les bases. Cette propriété est caractéristique de CR3+.
Lorsque vous réagissez avec les acides, CR (OH2)3(OH)3 Il est dissous parce que les ponts hydroxyles sont brisés, responsables de la gelée du précipité.
D'un autre côté, lorsque plus de base est ajoutée, oh- Ils continuent de remplacer les molécules d'eau, formant le complexe négatif [CR (OH2)2(OH)4]]-. Ce complexe tourne la solution d'une couleur vert clair, qui s'intensifie à mesure que la réaction continue.
Quand tout cr (oh2)3(OH)3 Vous avez réagi, un dernier complexe est obtenu comme indiqué par l'équation chimique:
Cr (oh2)3(OH)3 + 3 oh- [CR (OH)6]] 3- + 3 h2SOIT
Ce complexe négatif est associé aux cations environnantes (na+, Si la base est naoh), et après l'évaporation de l'eau, le sel de chromito de sodium (Nacro2, couleur verte émeraude). Ainsi, l'acide et le milieu de base sont capables de dissoudre l'hydroxyde de chrome.
Peut vous servir: indienSynthèse de l'hydroxyde de chrome dans le domaine industriel
Dans l'industrie, il est produit par des précipitations de sulfate de chrome avec des solutions d'hydroxyde de sodium ou d'hydroxyde. De même, l'hydroxyde de chrome est produit par réaction schématique:
Cro72- + 3 donc2 + 2h+ => 2 cr3+ + 3 donc42- + H2SOIT
Croisement3+ + 3OH- => Cr (OH)3
Comme le montre la procédure précédente, la réduction du chrome VI à Chrome III a une grande importance écologique.
Le chrome III est relativement inoffensif pour le biote, tandis que le chrome VI est toxique et cancérigène, en plus de très soluble, donc son élimination de l'environnement est importante.
La technologie de traitement de l'eau et du sol comprend une réduction de Cr (VI) à CR (III).
Applications
L'hydroxyde de chrome a diverses applications:
- Formulation de maquillage.
- Teintures pour cheveux.
- Vernis à ongle.
- Produits de soins de la peau.
- Produits de nettoyage.
- Dans la finition métallique, qui représente 73% de sa consommation dans l'industrie.
- Dans la préservation du bois.
Les références
- Whitten, Davis, Peck & Stanley. Chimie. (8e Ed.). Cengage Learning, p 873, 874.
- Se publier. Hydroxyde chromique. Récupéré de pubchem.NCBI.NLM.NIH.Gouvernement
- Synthèse, caractérisation et stabilité des hydroxydes Cr (III) et Fe (III). Papassiopi, n., VAXEVANIDOU, K., Christou, C., Karagianni, e. et antipas, g. J. Danger. 264: 490-497.
- Prébchem. Préparation de l'hydroxyde de chrome (III). Récupéré de prepchem.com
- Wikipédia. (2018). Chrome (iii) hydroxyde. Récupéré de.Wikipédia.org