Hydroxyde de calcium (CA (OH) 2) Structure, propriétés, obtenant, utilisations

- 1133
- 299
- Lucas Schneider
Il hydroxyde de calcium C'est un composé inorganique dont la formule chimique est CA (OH)2. Il s'agit d'une poudre blanche qui est utilisée depuis des milliers d'années, tout au long duquel il a remporté plusieurs noms ou surnoms traditionnels; Parmi eux, nous pouvons mentionner le terne, mort, chimique, hydraté ou fin.
Dans la nature, il est disponible dans un petit minéral abondant appelé Portlandita, de la même couleur. À cause de cela le CA (OH)2 Il n'est pas obtenu directement à partir de ce minéral, mais d'un traitement thermique, suivi d'une hydratation, de calcaire. Ceci est obtenu par Lime, Cao, qui s'éteint par la suite ou hydrate pour produire le CA (OH)2.
 Un échantillon solide d'hydroxyde de calcium. Source: Chemical Intestrest [Domaine public]
Un échantillon solide d'hydroxyde de calcium. Source: Chemical Intestrest [Domaine public] Le CA (OH)2 Il s'agit d'une base relativement faible dans l'eau, car elle peut à peine se dissoudre dans l'eau chaude; Mais sa solubilité augmente dans l'eau froide, car son hydratation est exothermique. Cependant, sa basicité continue d'être une raison d'être prudente avec elle pendant sa manipulation, car elle peut provoquer des brûlures n'importe où dans le corps.
Il a été utilisé comme régulateur de pH pour différents matériaux ou aliments, en plus d'être une bonne source de calcium en ce qui concerne sa masse. Il a des applications dans l'industrie du papier, dans la désinfection des eaux usées, dans les produits dépilatants, dans l'épicerie en farine de maïs.
Cependant, son utilisation la plus importante a été le matériau de construction, car la chaux est hydratée lors du mélange avec les autres ingrédients du plâtre ou du mortier. Dans ces mélanges durcis, CA (OH)2 Absorber le dioxyde de carbone de l'air pour consolider les cristaux de sable ainsi que le carbonate de calcium formé.
Actuellement, la recherche est toujours effectuée dans le but de développer de meilleurs matériaux de construction qui ont CA (OH)2 directement dans sa composition comme nanoparticules.
[TOC]
Structure
Crystal et ses ions
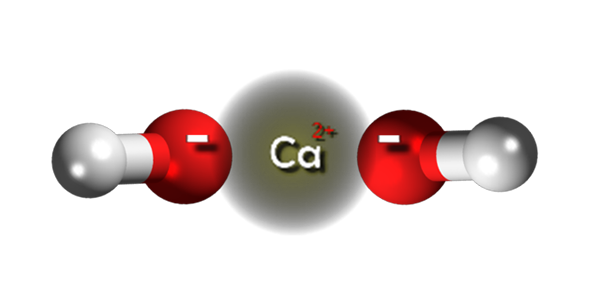 Ions d'hydroxyde de calcium. Source: Claudio Pistilli [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)]
Ions d'hydroxyde de calcium. Source: Claudio Pistilli [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)] Dans l'image supérieure, nous avons les ions qui intègrent l'hydroxyde de calcium. Sa même formule CA (OH)2 souligne que pour chaque cation ca2+ Il y a deux anions oh- qui interagissent avec lui par l'attraction électrostatique. Le résultat est que les deux ions finissent par établir un cristal de structure hexagonale.
Dans de tels cristaux hexagonaux de Ca (OH)2 Les ions sont très proches les uns des autres, ce qui donne l'apparence d'être une structure polymère; Bien qu'il n'y ait pas officiellement une liaison covalente CA-O, étant toujours donné la différence remarquable d'électronégativité entre les deux éléments.
 Structure d'hydroxyde de calcium
Structure d'hydroxyde de calcium La structure génère Octaedros Cao6, c'est-à-dire le CA2+ interagir avec six oh- (AC2+-Oh-).
Il peut vous servir: hydroxyde de lithium (LIOH)Une série de ces octaèdres constitue une couche de verre, qui peut interagir avec une autre par des ponts d'hydrogène qui les maintiennent intermoléculairement cohésive; Cependant, cette interaction s'estompe à une température de 580 ºC, lorsque le Ca (OH) est déshydraté2 à Cao.
Sur le côté des pressions élevées, il n'y a pas beaucoup d'informations à ce sujet, bien que des études aient vérifié qu'à une pression de 6 GPa, le verre hexagonal souffre d'une transition de l'hexagonal à la phase monoclinique; Et avec cela, la déformation de l'Octaedros Cao6 et ses couches.
Morphologie
Les cristaux Ca (OH)2 Ils sont hexagonaux, mais ce n'est pas un obstacle pour eux d'adopter une morphologie. Certaines de ces structures (brins, flocons ou rochers) sont plus poreuses que d'autres, robustes ou plates, ce qui influence directement leurs applications finales.
Ainsi, ce n'est pas la même chose d'utiliser des cristaux du minéral de Portland, que de les synthétiser afin qu'ils se composent de nanoparticules où quelques paramètres rigoureux sont suivis; comme le degré d'hydratation, la concentration du CAO utilisé et le temps autorisé à faire pousser du verre.
Propriétés
Apparence physique
Blanc massif, toilettes et goût amer solide.
Masse molaire
74 093 g / mol
Point de fusion
580 ºC. À cette température, il décompose en libérant de l'eau, de sorte qu'il n'atteint jamais pour se vaporiser:
Ca (oh)2 => Cao + H2SOIT
Densité
2 211 g / cm3
pH
Une solution aqueuse de celui-ci a un pH de 12,4 à 25 ºC.
Solubilité dans l'eau
La solubilité de Ca (OH)2 Dans l'eau diminue avec une augmentation de la température. Par exemple, à 0 ºC, sa solubilité est de 1,89 g / L; Alors qu'à 20 ºC et 100 ºC, ceux-ci sont respectivement de 1,73 g / L et 0,66 g / L.
Cela indique un fait thermodynamique: hydratation de l'AC (OH)2 Il est exothermique, obéissant donc au principe du catelier que l'équation serait:
Ca (oh)2 CA2+ + 2OH- + Q
Où est la chaleur libérée. Plus l'eau est chaude, l'équilibre tendra davantage vers la gauche; c'est-à-dire que le CA (OH) se dissoudra moins2. C'est pour cette raison que dans l'eau froide se dissout beaucoup plus que dans l'eau bouillante.
D'un autre côté, cette solubilité augmente si le pH devient acide, en raison de la neutralisation des ions OH- et au déplacement de l'équilibre précédent à droite. Pendant ce processus, encore plus de chaleur est libérée que dans l'eau neutre. En plus des solutions aqueuses acides, CA (OH)2 Il est également soluble dans le glycérol.
K$
5,5 · 10-6. Cette valeur est considérée comme petite et est d'accord avec la faible solubilité de CA (OH)2 Dans l'eau (le même équilibre ci-dessus).
Peut vous servir: métauxIndice de réfraction
1 574
La stabilité
Le CA (OH)2 Il reste stable tant qu'il n'est pas exposé au CO2 de l'air, car il l'absorbe et forme du carbonate de calcium, caco3. Par conséquent, il commence à être impurifié dans un mélange solide de cristaux de Ca (OH)2-Voleur3, Où il y a des co-anions32- rivaliser avec oh- Pour interagir avec CA2+:
Ca (oh)2 + CO2 => Caco3 + H2SOIT
En fait, c'est la raison pour laquelle les solutions concentrées de CA (OH)2 Ils tournent les lits, alors qu'une suspension de particules de caco apparaît3.
Obtention
Le CA (OH)2 Il est obtenu commercialement en réagissant le chaux, CAO, avec un excès de deux à trois fois d'eau:
Cao + H2O => CA (OH)2
Cependant, la carbonisation de Ca (OH) peut se produire dans le processus2, Tout comme expliqué ci-dessus.
D'autres méthodes pour l'obtenir consistent à utiliser des sels de calcium solubles, comme le clic2 ou CA (non3)2, et les baser avec Naoh, de sorte que le CA (OH) se précipite2. Contrôle des paramètres tels que des volumes d'eau, de température, de pH, de solvant, de degré de carbonisation, de temps de maturation, etc., Les nanoparticules avec différentes morphologies peuvent être synthétisées.
Il peut également être préparé en sélectionnant des matières premières naturelles et renouvelables, ou le gaspillage d'une industrie qui sont riches en calcium, qui lorsque leurs cendres sont chauffées et traitées se composeront de chaux; Et à partir d'ici, encore une fois, CA (OH) peut être préparé2 En hydratant ces cendres sans avoir besoin de gaspiller du calcaire, caco3.
Par exemple, le Bagazo del Agave a été utilisé à cette fin, attribuant une valeur ajoutée au gaspillage des industries de la tequila.
Applications
Traitement des aliments
 Les cornichons sont d'abord trempés dans l'hydroxyde de calcium pour être plus croustillant. Source: Pixabay.
Les cornichons sont d'abord trempés dans l'hydroxyde de calcium pour être plus croustillant. Source: Pixabay. L'hydroxyde de calcium est présent dans de nombreux aliments à certains de ses étapes de préparation. Par exemple, dans une solution aqueuse, les cornichons sont immergés, comme les concombres, pour les rendre plus croquants lors de leur emballage dans du vinaigre. En effet, les protéines de leur surface absorbent le calcium au milieu.
De même, il se produit avec les grains de maïs avant de les transformer en farine, car il aide à libérer la vitamine B3 (Niacina) et facilite son broyage. Le calcium qu'il fournit est également utilisé pour ajouter une valeur nutritionnelle à certains jus.
Le CA (OH)2 Vous pouvez également remplacer la levure chimique dans certaines recettes de pain et clarifier les solutions de canne à canne à sucre et les betteraves.
Désinfectant des eaux usées
Action clarifiant de CA (OH)2 C'est parce qu'il agit comme un agent floculant; c'est-à-dire que la taille des particules en suspension augmente pour former un floculus, qui par la suite sédiment ou peut filtrer.
Peut vous servir: échelle de paulingCette propriété a été utilisée pour désinfecter les eaux usées, déstabilisant ses colloïdes désagréables en vue (et odeur) des spectateurs.
Industrie du papier
Le CA (OH)2 Il est utilisé dans le processus Kraft pour régénérer le naOH utilisé pour traiter le bois.
Absorbant au gaz
Le CA (OH)2 Il est utilisé pour éliminer le CO2 d'espaces fermés ou dans des environnements où leur présence est contre-productive.
Soins personnels
Dans les formulations pour les crèmes dépilatoires, le CA (OH)2 Il est tacitement, car sa basicité aide à affaiblir la kératine des poils, et donc, il est plus facile de les retirer.
Les travaux de construction
 L'hydroxyde de calcium fait partie des structures des œuvres de construction anciennes telles que les pyramides d'Égypte. Source: Pexels.
L'hydroxyde de calcium fait partie des structures des œuvres de construction anciennes telles que les pyramides d'Égypte. Source: Pexels. Le CA (OH)2 Il est présent depuis des temps immémoriaux intégrant les masses de plâtre et de mortier utilisées dans la construction d'œuvres architecturales égyptiennes telles que les pyramides; Aussi bâtiments, mausolées, murs, escaliers, planchers, supports et même pour reconstruire le ciment dentaire.
Son action fortifiante est due au fait qu'en «respirant» le CO2, Les cristaux résultant de Caco3 Les sables et autres composants de ces mélanges finissent à un meilleur degré.
Risques et effets secondaires
Le CA (OH)2 Ce n'est pas un solide fortement basique par rapport aux autres hydroxydes, bien que plus que le Mg (OH)2. Même ainsi, bien qu'il ne soit pas réactif ou inflammable, sa basicité est encore suffisamment agressive pour provoquer de légères brûlures.
Par conséquent, il doit être manipulé avec respect, car il est capable d'irriter les yeux, la langue et les poumons, en plus de déclencher d'autres maux tels que: perte de vision, alcalinisation sévère du sang, éruptions cutanées, vomissements et douleurs à la gorge.
Les références
- Fhiver & Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Wikipédia. (2019). Calcium d'hydroxyde. Récupéré de: dans.Wikipédia.org
- Chávez Guerrero et al. (2016). Synthèse et caractérisation de l'hydroxyde de calcium obtenu à partir de la bagasse d'agave et des recherches de son activité antibactérienne. Récupéré de: SCIELO.org.mx
- Riko Iizuka, Takehiko Yagi, Kazuki Komatsu, Hirotada Gotou, Taku Tsuchiya, Keiji Kusaba, Hiroyuki Kagi. (2013). Structure cristalline de la phase à haute pression de l'hydroxyde de calcium, Portlandite: sur la poudre de situ et l'étude de diffraction des rayons X monocristallines. Minéralogiste américain; 98 (8-9): 1421-1428. Doi: doi.org / 10.2138 / Am.2013.4386
- Hans Lohninger. (5 juin 2019). Calcium d'hydroxyde. CHIMISTER BOOLISTexts. Récupéré de: Chem.Bibliothèque.org
- Aniruddha s. et al. (2015). Synthèse de l'hydroxyde de nano calcium dans le milieu d'affliction. L'American Ceramic Society. est ce que je.org / 10.1111 / Jace.14023
- Carly Vandergrindt. (12 avril 2018). Comment l'hydroxyde de calcium est-il utilisé dans les aliments, et est-il sûr? Récupéré de: Healthline.com
- Brian Clegg. (26 mai 2015). Calcium d'hydroxyde. Récupéré de: Chemistryworld.com
- « Caractéristiques et exemples des phénomènes chimiques
- Caractéristiques de Mesohyppus, espèces, reproduction, nutrition »

