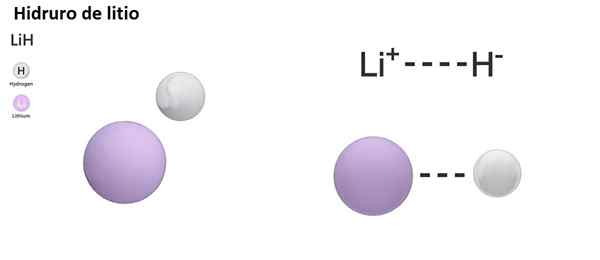Hydrate
- 3212
- 880
- Noa Da silva
Que sont les hydruros?
Les hydros sont des composés chimiques qui résultent de la réaction de l'hydrogène avec des éléments métalliques (sodium, potassium, calcium, etc.) et non les métaux (chlore, fluor, oxygène, azote, carbone, etc.). L'hydrogène réagit avec presque tous les éléments chimiques, donc les hydrors sont des substances très diverses.
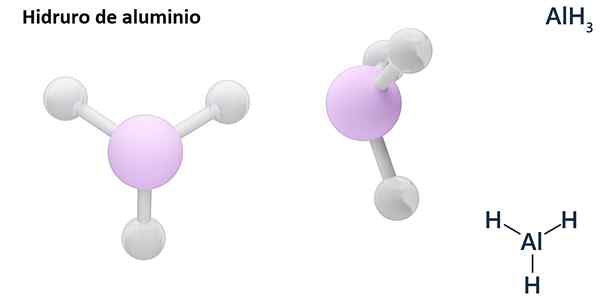
Ses formules générales peuvent être le type MHn, Où m est en métal et n Son Valencia (+1, +2, +3), comme l'hydrure d'aluminium, ALH3; ou du type ehn ou hnEt, où E est un élément non métallique et n Son Valence, comme NH3 ou h2S.
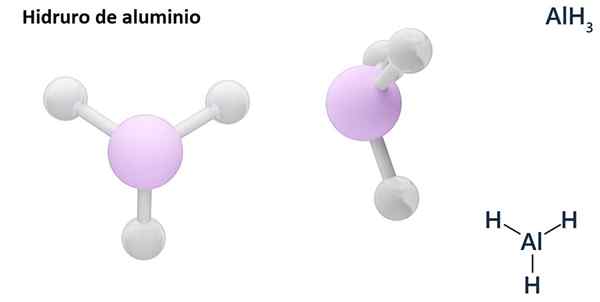
Les hydros sont généralement des composés binaires, c'est-à-dire qu'ils résultent de la combinaison d'hydrogène avec un autre élément chimique. Cependant, l'hydrogène peut également établir des combinaisons avec plusieurs éléments chimiques, pour former des hydrors plus complexes. Toutes les hydrors expliqués seront binaires, comme ALH3 et non.
Il existe trois types d'hydrors selon la nature de sa liaison chimique: ionique, moléculaire et métallique. Les hydrors ioniques ou salines sont caractérisés par la présence d'une liaison ionique. Ce lien se compose de l'attraction électrique entre la charge positive d'un métal alcalin (Na+) ou la boulle alcaline (mg2+), et la charge négative de l'anion hydrure (h-).
Les hydrures moléculaires, en revanche, sont caractérisés par la formation d'une liaison covalente entre l'hydrogène et un élément non métallique. Parmi les éléments non métalliques qui forment les hydros figurent: le chlore, le brome, le fluor, l'iode, l'oxygène et l'azote.
Et les hydroors métalliques résultent de la combinaison d'hydrogène avec certains métaux de transition. Ce type d'hydraudes, contrairement aux précédents, a des structures complexes et ne sera pas expliquée ici.
Propriétés Hydros
Les propriétés des herbes varient en fonction du type d'hydrure: ionique, moléculaire ou métallique, de sorte que leurs propriétés doivent être indiquées séparément.
Hydrors ioniques ou salines
Ce sont des solides blancs cristallins, mais en raison de la présence d'impuretés, ils acquièrent une couleur grisâtre. Ces hydrades ne sont pas solubles dans les solvants courants, comme l'eau, l'alcool, etc. Ils ont également des points d'ébullition et de fusion élevés.
Ils ont une densité d'état élevée et fondée.
Les hydurns ioniques sont considérés comme basiques ou alcalins, car dissous dans la forme d'eau hydroxydes et libèrent de l'hydrogène moléculaire:
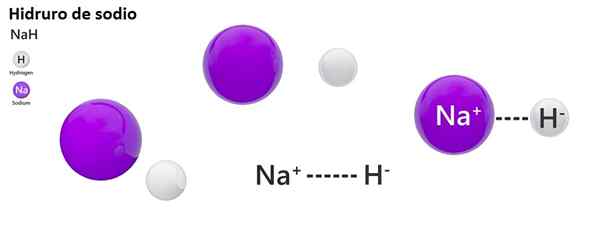
Nah + H2O → H2 + Naoh
La réaction de l'hydrate ionique avec l'eau est très vigoureuse et dangereuse: elle produit de l'hydrogène sous une forme gazeuse, qui est un matériau combustible et inflammable.
Les hydurns ioniques peuvent également réagir avec des halogénures métalliques, formés par un métal et un non-métal connu sous le nom d'halogène (Mx, X = F, Cl, Br, I):
Peut vous servir: diméthylanylin: structure, propriétés, synthèse, utilisations4 lih + alcl3 → lialh4 + 3 LICL
LIH (lithium hydrure) est un composé binaire; tandis que le lialh4 (Hydrure de lithium et d'aluminium) est un composé ternaire, c'est-à-dire qu'il se compose de trois éléments chimiques.
Hydros moléculaire ou covalente
Ils sont à l'état liquide ou gazeux contrairement aux hydrors ioniques, qui sont solides. Ils ont de faibles points d'ébullition et de fusion, observant qu'en augmentant le poids moléculaire de l'hydrure, le point d'ébullition augmente; Sauf pour l'ammoniac (NH3), Eau (h2O) et hydrure de fluor (HF).
Les hydrades covalents sont de mauvais conducteurs d'électricité et bon nombre de leurs propriétés sont dues à la formation de ponts d'hydrogène. Les hydrades covalents sont considérés comme des acides, car dissous dans l'eau peut provoquer des acides, par exemple, l'acide chlorhydrique.
Hydromes métalliques
Ils sont à l'état solide, présentant le ton sombre des métaux. Ce sont de bons conducteurs d'électricité et ont des surfaces brillantes. Les hydrures métalliques stables dans l'air deviennent des réactifs lorsqu'ils chauffent, par exemple, l'hydrure d'uranium (UH3) Présenter cette propriété.
Nomenclature
La façon de nommer Hydrerors est simple et ne varie pas trop dans aucune des nomenclatures. Si le métal ou l'élément métallique a plus d'une valence, il est spécifié entre parenthèses et avec numéro romain selon la nomenclature des stocks.
Par exemple, le feh3 est appelé l'hydrure de fer (iii), et coh2 Cobalt Hydro (II). Ces mêmes hydrures peuvent également être nommés en utilisant la nomenclature systématique, qui utilise les nombres grecs (DI, Tri, Tetra, etc.). Ainsi, le feh3 est appelé trihydride de fer et coh2 cobalt dihydruro.
La nomenclature classique n'est pas largement utilisée pour les hydros. Par exemple, Nah est connu davantage sous le nom d'hydrure de sodium et non d'hydrure de sodium.
 Hydrure de sodium
Hydrure de sodium Comment les hydros sont-ils formés?
Hydrors ioniques ou salines
Ils sont formés par la réaction de l'hydrogène avec un métal appartenant au groupe de métaux alcalins ou au groupe de métaux alcalins-terrore.
Dans Hydrors entraînés avec ces métaux, l'hydrogène se trouve sous la forme h-, connu sous le nom d'anion hydrure.
Les métaux alcalins (lithium, sodium, potassium, rubidium et césium) réagissent avec l'hydrogène pour former leurs hydurns correspondants:
2 m (l) + h2(g) → 2mh (s)
Peut vous servir: opérations unitairesLe métal m lors de la réaction est à l'état liquide et l'hydrogène à l'état gazeux, donc la réaction nécessite des températures élevées et des pressions élevées. Considérez l'exemple suivant:
2 li (l) + h2 (g) → 2 lih (s)
La réaction de l'hydrogène avec des métaux alcalins-troisième (béryllium, magnésium, calcium, strontium et baryum), pour la formation d'hydrure, est similaire à celle observée avec des métaux alcalins.
Le magnésium et le béryllium forment des hydrures, mais leurs liaisons avec l'hydrogène sont de type covalent; C'est-à-dire non ionique, contrairement à d'autres métaux alcalins:
Ca (l) + h2 (g) → CAH2 (S)
Hydromes moléculaires
L'hydrogène peut réagir avec des non-métaux, correspondant aux groupes 14, 15, 16 et 17 du tableau périodique, pour former des hydrors moléculaires. Considérez, par exemple, la formation d'hydrure de fluorure par combinaison ou mélange direct d'hydrogène avec du fluor:
H2 (g) + f2 (g) → 2 hf (g)
HF est davantage connu comme fluorure d'hydrogène, mais il est également appelé hydrure de fluorure.
De plus, l'hydrogène peut réagir avec l'oxygène (groupe 16 du tableau périodique) suivant le même schéma:
2 h2 (g) + ou2 (g) → 2 h2O (g)
La réaction nécessite une alimentation thermique pour produire de l'oxyde d'hydrogène (eau) ou de l'hydrure d'oxygène.
De plus, l'hydrogène peut réagir avec l'azote, appartenant au groupe 15 du tableau périodique pour former l'hydrure d'azote, mieux connu sous le nom d'ammoniac (NH3).
N2 (g) +3 h2 (g) → 2 NH3 (g)
La réaction nécessite l'alimentation thermique, la haute pression et la présence de catalyseurs (ils accélèrent les réactions chimiques).
Hydromes métalliques
Ils sont formés par la réaction des métaux de transition (groupes 3, 4, 5, 6, 10, 11 et 12 du tableau périodique) avec de l'hydrogène. Cependant, les métaux de transition des groupes 7, 8 et 9 ne forment pas de composés avec de l'hydrogène, un phénomène connu sous le nom d'espace hydrure ou d'hydrure d'espace.
Une caractéristique unique des métaux de transition hydroors est qu'ils ne présentent pas toujours une proportion fixe entre le nombre d'atomes d'hydrogène et le nombre d'atomes présents dans l'hydrure. C'est-à-dire que leurs formules et leurs structures ne sont pas simples à représenter.
Utilisations / applications d'hydros
 Les hydros sont très présents dans l'un des nombreux types de batteries: comme Nimh. Source: Multicherry, CC BY-SA 4.0, via Wikimedia Commons
Les hydros sont très présents dans l'un des nombreux types de batteries: comme Nimh. Source: Multicherry, CC BY-SA 4.0, via Wikimedia Commons Les hydros sont présents dans les batteries hydrure métalliques du nickel (NIMH), utilisées conjointement avec des métaux de terres rares, du cobalt ou du manganèse. Plusieurs hydrors métalliques ont été examinés pour être utilisés dans des voitures électriques entraînées par des cellules liées à l'hydrogène.
Peut vous servir: Méthode d'équilibre redox: étapes, exemples, exercicesLes agents réducteurs
Hydrure de lithium et bore de sodium (NABH4) Ils sont utilisés comme réactions chimiques dans les réactions de synthèse organique.
Stockage d'hydrogène et autres utilisations connexes
Il y a des pilotes d'utilisation d'hydrogène comme carburant dans les véhicules à moteur, mais en raison de son explosivité, son utilisation a été limitée comme carburant. L'utilisation d'hydros a été proposée comme une forme de stockage d'hydrogène, pour contrôler ainsi leur danger.
De plus, les hydrors ont été utilisés pour la purification et la séparation de l'hydrogène et des capteurs de température.
Dessiccants
L'hydrure de calcium est utilisé pour éliminer l'eau présente dans les solvants organiques.
Acides provenant d'hydrors moléculaires
Par exemple: l'acide chlorhydrique est formé par la solution dans un milieu aqueux d'hydrate de chlore (HCl), en utilisant de l'acide chlorhydrique dans l'élimination des oxydes qui couvrent le fer, l'acidification des puits de pétrole, la production du chlorure de calcium et de traitement minéral.
Les engrais
L'ammoniac (NH3) C'est un hydrure qui est utilisé comme engrais liquide et sert à la synthèse de composés avec du nitrate d'ammonium et du sulfate d'ammonium, qui sont utilisés comme engrais.
L'eau
Est l'hydrure le plus important. Il est utilisé dans de nombreuses industries avec différentes utilisations et applications. L'eau est le principal responsable de l'existence des êtres vivants.
Exemples d'hydroors
Enfin, d'autres exemples d'hydrors seront répertoriés avec leurs formules et noms respectifs:
SNH4: Hydrure d'étain | PH3: phosphore hydrure (phosphine) ou trihydride de phosphore |
Kh: hydrure de plomb | MGH2: Hydrure de magnésium ou magnésium dihydruro |
Kh: hydrure de potassium | CH4: Carruro carruro ou tétrahydride de carbone (méthane) |
CAH2: hydrure de calcium | FEH2: Iron Hydrure (II) |
Non: hydrure de sodium | Znh2: Hydrure de zinc |
Lih: hydrure de lithium | BAH2: hydrure de baryum |
CSH: Hydrure de césium | BH3: Boron Hydro (BAS |
BEH2: hydrure de dihydride Beryl ou Beryl | SIH4: Hydro Silicon (Silan) |
Les références
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning.
- Fhiver & Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Wojes, Ryan. (27 août 2020). Qu'est-ce qu'un hydrure métallique? Récupéré de: Thoughtco.com
- Éléments américains. (2020). Hydride. Récupéré de: Américains.com
- Wikipédia. (2020). Hydrure. Récupéré de: dans.Wikipédia.org
- Tandis Arani. (15 août 2020). Hydride. CHIMISTER BOOLISTexts. Récupéré de: Chem.Bibliothèque.org
- Les éditeurs d'Enyclopaedia Britannica. (2020). Hydrure. Récupéré de: Britannica.com