Histoire de l'hélio, propriétés, structure, risques, utilisations

- 1724
- 165
- Prof Noah Collet
Il hélium C'est un élément chimique dont le symbole est. Il s'agit du premier gaz noble dans le tableau périodique, et est généralement situé à la fin du même. Dans des conditions normales, c'est un gaz inerte, car aucun de ses rares composés n'est stable; Il se développe également très rapidement et est la substance avec le moindre point d'ébullition de tous.
Au niveau populaire, c'est un gaz bien connu, car dans d'innombrables événements ou des fêtes pour enfants, il est courant. Cependant, ce qui est vraiment et pour toujours perdu envers les coins du système solaire, et au-delà, ce sont les atomes d'hélium qui sont libérés une fois que le globe est décomposé.
 Ballons gonflés avec de l'hélium, le plus proche qui puisse être de cet élément dans des situations quotidiennes. Source: Pixabay.
Ballons gonflés avec de l'hélium, le plus proche qui puisse être de cet élément dans des situations quotidiennes. Source: Pixabay. En fait, il y a ceux qui, et avec grande raison, croient que les ballons d'hélium représentent une pratique inappropriée pour ce gaz. Heureusement, il a des utilisations plus importantes et intéressantes, grâce à ses propriétés physiques et chimiques qui la séparent des autres éléments chimiques.
Par exemple, l'hélium liquide est si froid qu'il peut geler n'importe quoi, en tant qu'alliage métallique, ce qui en fait un matériau supraconducteur. C'est aussi un liquide qui manifeste la superfluidité, capable de gravir les murs d'un récipient en verre.
Son nom est parce qu'il a été identifié pour la première fois au soleil et non sur Terre. C'est le deuxième élément le plus abondant de l'univers entier et, bien que sa concentration soit ridicule dans la croûte terrestre, elle peut être obtenue à partir des réserves de gaz naturel et de minéraux radioactifs de l'uranium et du thorium.
Ici, l'hélium démontre un autre fait curieux: c'est un gaz qui abonde beaucoup plus dans le sous-sol que dans l'atmosphère, où il finit par s'échapper de la terre et de son champ gravitationnel.
[TOC]
Histoire
L'hélium n'a pas été découvert sur terre mais au soleil. En fait, son nom vient du mot grec «Helios» qui signifie Soleil. L'existence de l'élément à elle seule contraste le tableau périodique de Dmitri Mendeléyev, car il n'y avait pas de place pour un nouveau gaz; c'est-à-dire, il n'y avait absolument rien dans les gaz nobles.
Le nom «Helio», écrit en «hélium» en anglais, s'est terminé avec le suffixe -ium qui l'appelle comme un métal; Précisément parce que l'existence d'un autre gaz à l'exception de l'oxygène, de l'hydrogène, du fluor, du chlore et de l'azote n'a pas pu être admis.
Ce nom a été désigné par l'astronome anglais Norman Lockyer, qui a étudié en Angleterre ce qui a été observé par l'astronomie française.
C'était une ligne spectrale jaune d'un élément inconnu jusque-là. Lockyer a déclaré que cela était dû à la présence d'un nouvel élément chimique trouvé au soleil.
En 1895, près de vingt ans plus tard, le chimiste écossais Sir William Ramsay a reconnu le même spectre d'un gaz restant lors de l'étude d'un minéral radioactif: Cleveíta. Il y avait donc Helio ici aussi.
Proprietes physiques et chimiques
Apparence
 Ampoule avec un échantillon d'hélium brillant après un choc électrique. Source: Images haute résolution d'éléments chimiques [CC par 3.0 (https: // CreativeCommons.Org / licences / par / 3.0)]
Ampoule avec un échantillon d'hélium brillant après un choc électrique. Source: Images haute résolution d'éléments chimiques [CC par 3.0 (https: // CreativeCommons.Org / licences / par / 3.0)] L'hélium est un gaz incolore et inodore, qui n'a pas de saveur et est également inerte. Cependant, lorsqu'un choc électrique est appliqué, et en fonction de la différence de tension, il commence à briller comme une brume grisâtre (image supérieure), pour briller avec une lueur orange. Par conséquent, les lumières d'hélium sont orange.
Numéro atomique (z)
2
Masse molaire
4,002 g / mol
Point de fusion
-272.2 ºC
Point d'ébullition
-268,92 ºC
Densité
-0,1786 g / L, dans des conditions normales, c'est-à-dire en phase gazeuse.
-0,145 g / ml, au point de fusion, l'hélium liquide.
-0,125 g / ml, juste au moment où l'hélium commence à bouillir.
-0,187 g / ml, à 0 K et 25 atm, c'est-à-dire l'hélium solide à ces conditions de pression et de température spécifiques.
Point triple
2 177 K et 5 043 kPa (0,04935 atm)
Point critique
5 1953 K et 0,22746 MPa (2 2448 ATM)
Chaleur de fusion
0,0138 kJ / mol
Chaleur de vaporisation
0,0829 kJ / mol
Capacité thermique molaire
20,78 J / (mol · k)
La pression de vapeur
0,9869 atm à 4,21 K. Cette valeur sert à donner une idée de la façon dont la flotte.
Énergies d'ionisation
-Premièrement: 2372.3 kJ / mol (il+ gazeux)
-Deuxième: 5250,5 kJ / mol (il2+ gazeux)
Les énergies d'ionisation pour l'hélium sont particulièrement élevées car l'atome de gaz doit perdre un électron, qui subit une forte charge nucléaire efficace. On peut également comprendre si la petite taille de l'atome est considérée et à quel point les deux électrons sont «proches» par rapport au noyau (avec leurs deux protons et deux neutrons).
Solubilité
Dans l'eau, 0,97 ml sont dissous pour 100 ml d'eau à 0 ºC, ce qui signifie qu'il est peu soluble.
Peut vous servir: oxalate d'ammoniumRéactivité
L'hélium est le deuxième élément chimique le moins réactif dans la nature. Dans des conditions normales, il réussit à affirmer qu'il s'agit d'un gaz inerte; Jamais (pour ce qu'il semble) ne peut être manipulé un composé d'hélium dans une pièce ou un laboratoire sans d'énormes pressions agissant dessus; Ou peut-être, des températures considérablement élevées ou basses.
Un exemple que nous voyons dans le composé NA2Lui, qui est stable uniquement sous une pression de 300 GPa, reproduit dans une cellule de yunque de diamant.
Tandis que les liaisons chimiques dans le nA2Ont des "étrangers" pour avoir leurs électrons bien situés dans les cristaux, ils sont loin des interactions simples des murs de van der et, par conséquent, il ne se compose pas simplement d'atomes d'hélium piégés par des agrégats moléculaires. C'est là que le dilemme entre lesquels les composés d'hélium sont réels et qui ne.
Par exemple, les molécules d'azote à des pressions élevées peuvent emprisonner un atome d'hélium pour provoquer une sorte de cliquetis2)onze.
De plus, il existe des complexes de subvertification endo des cations Fullerène, C60+n et C70+n, Dans les cavités duquel ils peuvent abriter des atomes d'hélium; et le cation moléculaire heh+ (IL H+), trouvé dans des nébuleuses très éloignées.
Numéro d'oxydation
Qui, par curiosité, essaie de calculer le nombre d'oxydation de l'hélium dans l'un de ses composés constatera que cela est égal à 0. Dans le na2Il pourrait, par exemple, penser que sa formule correspond à des ions de na hypothétiques2+Il2-; Mais tel serait de supposer qu'il a un caractère ionique pur, alors qu'en réalité ses liens sont loin d'être.
De plus, l'hélium ne gagne pas d'électrons car il ne peut pas les accueillir dans l'énergie orbitale 2S indisponible; Et il n'est pas non plus possible que vous les perdiez, en raison de la taille réduite de son atome et de la grande charge nucléaire efficace de son noyau. C'est pourquoi l'hélium participe toujours (en théorie) en tant qu'atome0 Dans ses composés dérivés.
Structure et configuration électroniques
L'hélium, comme tous les gaz observés dans un macroescala, occupe le volume des conteneurs qui le stocke, ayant ainsi une manière indéfinie. Cependant, lorsque la température descend et commence à se refroidir en dessous de -269 ºC, le gaz se condense dans un liquide incolore; L'hélium I, le premier des deux phases liquides pour cet élément.
La raison pour laquelle l'hélium se condense à une température aussi basse est due aux quelques forces de dispersion qui maintiennent leurs atomes ensemble; Quelle que soit la phase considérée. Cela peut être expliqué à partir de sa configuration électronique:
12
Dans lequel deux électrons occupent l'orbital atomique 1. L'atome d'hélium peut être visualisé comme une sphère presque parfaite, dont la périphérie électronique homogène n'est pas très susceptible de polariser par la charge nucléaire efficace des deux protons dans le noyau.
Ainsi, les moments dipolaires spontanés et induits sont rares et très faibles; Ainsi, la température doit s'approcher du zéro absolu afin que les atomes aient approché une lenteur suffisante et que leurs forces dispersives définissent un liquide; Ou encore mieux, un verre d'hélium.
Dimères
Dans la phase gazeuse, l'espace qui sépare les atomes a tel qu'il peut être supposé que l'un des autres est toujours séparé. À tel point que dans une ampoule, de petit volume, l'hélium a l'air incolore jusqu'à ce qu'il soit soumis à un choc électrique, qui ionise ses atomes dans une brume grisâtre et peu brillante.
Cependant, dans la phase liquide, les atomes ont, même avec leurs faibles interactions, ils ne peuvent plus "ignorer" plus longtemps. Maintenant, la force de dispersion les permet2. Par conséquent, vous pouvez considérer l'hélium I comme de vastes grappes de lui2 en équilibre avec ses atomes de phase de vapeur.
C'est pourquoi l'hélium I est si difficile à se différencier de ses vapeurs. Si ce liquide est renversé à l'extérieur de son récipient hermétique, il s'échappe comme une poussée blanchâtre.
Helio II
Lorsque la température baisse encore plus, touchant les 2 178 K (-270 972 ºC), une transition de phase se produit: l'hélium I est transformé en hélium II.
À partir de ce point, le liquide d'hélium fascinant devient un fluide superflu ou quantique; c'est-à-dire que ses propriétés macroscopiques se manifestent comme si les dimères2 C'étaient des atomes individuels (et peut-être qu'ils le sont). Il manque de viscosité complète, car il n'y a pas de surface qui peut arrêter un atome pendant son glissement ou "grimpant".
C'est pourquoi Helio II peut s'élever à travers les murs d'un récipient en verre surmontant la force de gravité; Quelle que soit leur hauteur, tant que la surface reste à la même température et, par conséquent, ne volasez pas.
Il peut vous servir: acide hypophysaire (H3PO2): propriétés, utilisations et réactifsPour cette raison, l'hélium liquide ne peut pas être stocké dans des récipients en verre, car il s'échapperait avant la moindre fissure ou échappatoire; Très similaire à comment cela se produirait-il avec un gaz. Au lieu de cela, l'acier inoxydable est utilisé pour concevoir ces conteneurs (réservoirs Dewars).
Cristaux
Bien que la température descend jusqu'à 0 K (le zéro absolu), la force de dispersion entre les atomes, je ne serais pas assez forte pour les commander dans une structure cristalline. Pour faire de la solidification, la pression doit augmenter à environ 25 atm; Et puis, des cristaux hexagonaux compacts apparaissent (HCP).
Des études géophysiques montrent que cette structure HCP reste de loin inchangée que la pression augmente (jusqu'à l'ordre du Giga Pascal, GPA). Cependant, il y a une région étroite dans son diagramme à température pression où ces cristaux HCP subissent une transition vers une phase cubique centrée sur le corps (BCC).
Où est-il et obtenez
Cosmos et rochers
 L'hélium représente le deuxième élément le plus abondant de l'univers et 24% de sa masse. Source: pxhere.
L'hélium représente le deuxième élément le plus abondant de l'univers et 24% de sa masse. Source: pxhere. L'hélium est le deuxième élément le plus abondant dans l'univers, dépassé uniquement par l'hydrogène. Les étoiles produisent constamment des quantités incommensurables d'atomes d'hélium en fusionnant deux noyaux d'hydrogène pendant le processus de nucléosynthèse.
De même, tout processus radioactif qui émet des particules α est une source de production d'atomes d'hélium s'ils interagissent avec les électrons de l'environnement; Par exemple, avec ceux d'un corps rocheux dans des réservoirs de minéraux radioactifs d'uranium et de thorium. Ces deux éléments souffrent de décroissance radioactive, en commençant par l'uranium:
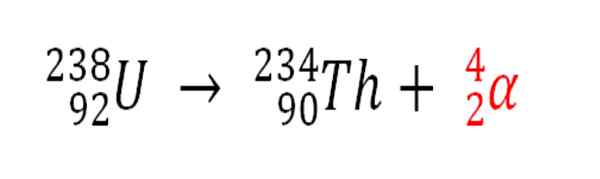 Décroissance radioactive dans l'uranium dans la formation de particules Alfas, qui se transforment par la suite en atome d'hélium dans les dépôts souterrains. Source: Gabriel Bolívar.
Décroissance radioactive dans l'uranium dans la formation de particules Alfas, qui se transforment par la suite en atome d'hélium dans les dépôts souterrains. Source: Gabriel Bolívar. Par conséquent, dans les rochers où ces minéraux radioactifs sont concentrés, les atomes d'hélium seront piégés, qui seront libérés une fois qu'ils seront digérés dans des milieux acides.
Parmi certains de ces minéraux se trouvent Cleveíta, Carnotita et Uraninite, tous composés d'oxydes d'uranium (UO2 ou u3SOIT8) et les impuretés du thorium, des métaux lourds et des terres rares. L'hélium, irrigué par les canaux souterrains, peut finir par s'accumuler dans les réservoirs de gaz naturel, les ressorts minéraux ou les fers météoriques.
On estime qu'une masse d'hélium équivalente à 3000 tonnes est produite chaque année, à partir de la désintégration radioactive de l'uranium et du thorium.
Air et mers
L'hélium n'est pas très soluble dans l'eau, si tôt que tard, il finit par monter à partir des profondeurs (où son origine est trouvée), pour traverser les couches de l'atmosphère et enfin atteindre l'espace sidéral. Ses atomes sont si petits et légers que le champ gravitationnel de la terre ne peut pas les conserver dans l'atmosphère.
En raison de ce qui précède, la concentration d'hélium à la fois dans l'air (5,2 ppm) et dans les mers (4 ppt) est très faible.
Si vous vouliez extraire de l'un de ces deux supports, la "meilleure" option serait l'air, qui devrait d'abord le soumettre à la liquéfaction pour condenser tous ses gaz composants, tandis que l'hélium reste dans un état gazeux.
Cependant, il n'est pas pratique d'obtenir l'hélium de l'air, mais des roches enrichies en minéraux radioactifs; ou mieux encore, de réserves de gaz naturel, où l'hélium peut représenter jusqu'à 7% de sa masse totale.
Liquéfaction et distillation au gaz naturel
Au lieu de soumettre l'air, c'est plus facile et plus rentable. Ainsi, la matière première par excellence (commerciale) pour obtenir l'hélium est le gaz naturel, qui peut également être soumis à une distillation fractionnée.
Le produit final de la distillation est fini de purifier avec du carbone activé, qui passe à travers une grande hélium de pureté. Et enfin, l'hélium se sépare du néon par un processus cryogénique où l'hélium liquide est utilisé.
Isotopes
L'hélium est présenté dans la nature principalement comme l'isotope 4Lui, dont le noyau nu est la célèbre particule α. Cet atome de 4J'ai deux neutrons et deux protons. En moindre abondance est l'isotope 3Lui, qui n'a qu'un seul neutron. Le premier est plus lourd (il a une plus grande masse atomique) que la seconde.
Ainsi, le couple isotope 3Lui et 4Ont ceux qui définissent les propriétés mésurables et ce que nous comprenons de l'hélium comme un élément chimique. Depuis le 3Il est plus léger, on suppose que leurs atomes ont plus d'énergie cinétique et que, par conséquent, ils ont besoin d'une température encore plus faible pour cohérenter dans un superflu.
Il 3J'ai considéré une espèce très rare ici sur Terre; Cependant, dans les sols lunaires, il est plus abondant (environ 2000 fois). C'est pourquoi la lune a été soumise à des projets et des histoires comme source possible de 3Lui, qui pourrait être utilisé comme combustible nucléaire pour le vaisseau spatial du futur.
Peut vous servir: substances puresParmi les autres isotopes d'hélium peuvent être mentionnés, avec leurs temps de demi-vie respectifs: 5IL (t1/2= 7,6 · 10−22 s), 6IL (t1/2= 0,8 s) et 8IL (t1/2= 0,119 s).
Des risques
L'hélium est un gaz inerte et, par conséquent, ne participe à aucune des réactions qui se produisent dans notre corps.
Ses atomes entrent pratiquement et sont expirés sans leurs interactions avec des biomolécules produisant un effet ultérieur; sauf dans le son émis par les cordes vocales, qui deviennent plus aiguës et ont plus de fréquence.
Les gens qui inspirent l'hélio d'un ballon (avec modération), parlent avec une voix aiguë, similaire à celle d'un écureuil (ou d'un canard).
Le problème réside dans le fait que si ladite personne inhale une quantité inappropriée d'hélium, le risque de suffocation des courses, car leurs atomes se déplacent vers les molécules d'oxygène; Et par conséquent, il ne pourra pas respirer tant que tout ce que l'hélium expire, qui à son tour en raison de sa pression peut déchirer le tissu pulmonaire ou provoquer des barotraumas.
Des cas de personnes décédées d'Helio inhale ont été signalées en raison de la nouvelle.
D'un autre côté, bien qu'il ne représente pas un risque d'incendie compte tenu de son manque de réactivité à l'oxygène (ou à une autre substance), s'il est stocké sous des pressions et des évasions élevées, son évasion peut être physiquement dangereuse.
Applications
Les propriétés physiques et chimiques d'Helio en font non seulement un gaz spécial, mais aussi une substance très utile pour les applications qui méritent des températures en extrême. Dans cette section, certaines de ces applications ou utilisations seront traitées.
Systèmes de pression et de purge
Dans certains systèmes, il est nécessaire d'augmenter la pression (pression), et pour cela, il doit être injecté ou une alimentation qui n'interagit avec aucun de ses composants; Par exemple, avec des réactifs ou des surfaces sensibles aux réactions indésirables.
Ainsi, la pression peut être augmentée avec les volumes d'hélium, dont l'inertie chimique le rend idéal à cet effet. L'atmosphère inerte qui facilite dépasse dans certains cas d'azote.
Pour le processus inverse, c'est-à-dire que la purge, l'hélium est également utilisée en raison de sa capacité à faire glisser tout oxygène, vapeurs d'eau ou tout autre gaz, dont la présence souhaite éliminer. De cette façon, la pression du système est réduite une fois que l'hélium a été vidé.
Détections de fuite
L'hélium peut être filtré à travers la moindre fissure, donc il sert également à détecter les fuites dans les tuyaux, les conteneurs à vide élevé ou les réservoirs cryogéniques.
Parfois, la détection peut être effectuée visuellement ou par contact; Cependant, principalement un détecteur est ce qui "lance" le signal de l'endroit où et de la quantité d'hélium échappe au système sous inspection.
Gaz traîner
Les atomes d'hélium, comme mentionné pour les systèmes de purge, peuvent le faire glisser, selon votre pression, des molécules plus lourdes. Par exemple, ce principe est utilisé quotidiennement dans l'analyse de la chromatographie en phase gazeuse, car il peut faire glisser l'échantillon atomisé le long de la colonne, où il interagit avec la phase stationnaire.
Ballons et dirigeables
 L'hélium est utilisé pour gonfler les dirigeables et est beaucoup plus sûr que l'hydrogène car il n'est pas un gaz inflammable. Source: Pixabay.
L'hélium est utilisé pour gonfler les dirigeables et est beaucoup plus sûr que l'hydrogène car il n'est pas un gaz inflammable. Source: Pixabay. En raison de sa faible densité par rapport à l'air et, encore une fois, à son manque de réactivité avec l'oxygène, il a été utilisé pour gonfler les ballons lors des fêtes des enfants (mélangés à l'oxygène afin que personne ne soit étouffé pour la respiration) et les dirigeables (image supérieure) , sans pouvoir représenter un risque de feu.
Plonger
 L'hélium est l'un des principaux composants des réservoirs d'oxygène avec lesquels les plongeurs respirent. Source: pxhere.
L'hélium est l'un des principaux composants des réservoirs d'oxygène avec lesquels les plongeurs respirent. Source: pxhere. Lorsque les plongeurs descendent à des profondeurs plus importantes, ils ont du mal à respirer à la suite de la grande pression exercée par l'eau. C'est pourquoi Helio est ajouté dans ses réservoirs d'oxygène pour réduire la densité du gaz que les plongeurs respirent et expirent, et donc, il peut être expiré avec moins de travail.
Soudage à l'arc
Dans le processus de soudage, l'arc électrique apporte suffisamment de chaleur pour que les deux métaux soient rejoints. S'il est effectué sous une atmosphère d'hélium, le métal à incandescence ne réagira pas avec l'oxygène de l'air pour devenir son oxyde respectif; Par conséquent, l'hélium empêche cela de se produire.
Supraconducteurs
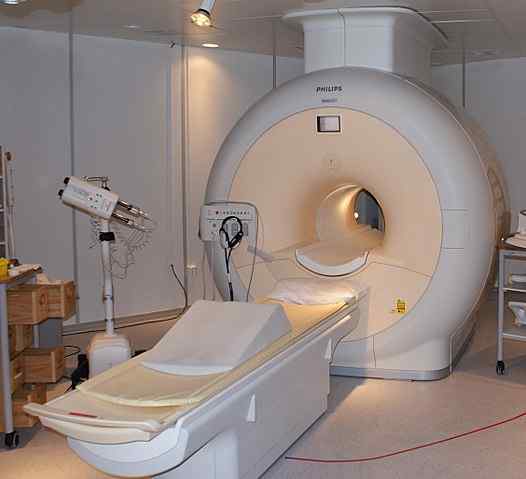 L'hélium liquide est utilisé pour réfrigérer les aimants utilisés dans les scanners de l'imagerie par résonance magnétique nucléaire. Source: Jan Ainali [CC par 3.0 (https: // CreativeCommons.Org / licences / par / 3.0)]
L'hélium liquide est utilisé pour réfrigérer les aimants utilisés dans les scanners de l'imagerie par résonance magnétique nucléaire. Source: Jan Ainali [CC par 3.0 (https: // CreativeCommons.Org / licences / par / 3.0)] L'hélium liquide est si froid qu'il peut geler les métaux pour les transformer en supraconducteurs. Grâce à cela, des aimants très puissants ont été fabriqués qui, réfrigérés avec de l'hélium liquide, ont été utilisés dans des images d'images ou de spectromètres de résonance magnétique nucléaire.
Les références
- Fhiver & Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Andy Estance. (17 avril 2019). Ion hydrure d'hélium détecté dans l'espace pour la première fois: preuves trouvées pour la chimie insaisissable dès les premières minutes de l'univers. Récupéré de: Chemistryworld.com
- Peter Wothers. (19 août 2009). Hélium. Chimie dans son élément. Récupéré de: Chemistryworld.com
- Wikipédia. (2019). Hélium. Récupéré de: dans.Wikipédia.org
- Mao, H. K., Wu, et., Jephcoat, un. P., Hemley, R. J., Cloche, p. M., & Bassett, W. POUR. (1988). Structure cristalline et densité de l'hélium jusqu'à 232 kbar. Récupéré de: Articles.Adsabs.Harvard.Édu
- Centre national d'information sur la biotechnologie. (2019). Hélium. Base de données PubChem. CID = 23987. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement
- Mary-Ann Muffoletto. (6 février 2017). Up, Up and Away: les chimistes disent «oui», l'hélium peut former des composés. Université d'État de l'Utah. Récupéré de: Phys.org
- Steve Gagnon. (s.F.). Isotopes de l'hélium élémentaire. Laboratoire de Jefferson. Récupéré de: éducation.Jlab.org
- Advameg, Inc. (2019). Hélium. Récupéré de: chimie-explayée.com

