Caractéristiques, structure, fonction et altérations de la globine
- 4895
- 1320
- Prof Ines Gaillard
La globine C'est une structure de nature protéique disposée sous forme sphérique ou globulaire, étant d'où son nom vient de. Cette structure est de type tertiaire et se caractérise par le complexe, car la chaîne d'acide aminé se replie pour former des sphéroprotéines. Il existe plusieurs types de chaînes de globin et celles-ci ont été classées en lettres grecques: Alfa, Beta, Delta, Gamma, Epsilon et Zeta.
Les acides aminés qui composent la structure primaire de la protéine varient selon les espèces auxquelles ils appartiennent (humains ou animaux). Il existe également des variations au sein de la même espèce selon l'état actuel de la vie de l'organisme (vie embryonnaire, vie fœtale ou post-naissance).
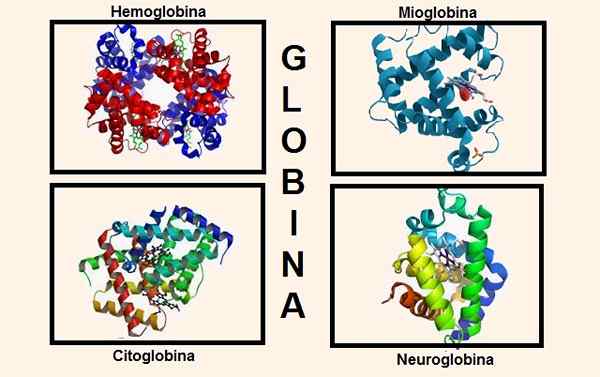
 Différentes structures contenant la globine dans sa composition. Sources: Wikipedia.com / biancadescals [cc by-sa 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)] / Le téléchargeur d'origine était ProteinBoxBot à l'anglais Wikipedia. [Domaine public] / Wikipedia.com
Différentes structures contenant la globine dans sa composition. Sources: Wikipedia.com / biancadescals [cc by-sa 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)] / Le téléchargeur d'origine était ProteinBoxBot à l'anglais Wikipedia. [Domaine public] / Wikipedia.com Les informations génétiques pour la synthèse des différentes chaînes de globine sont contenues dans divers chromosomes. Par exemple, les globines de chaîne alpha se trouvent sur le chromosome 16, tandis que les informations génétiques de la bêta, du delta, du gamma et de l'epsilon sont sur le chromosome 11.
[TOC]
Caractéristiques
La globine fait partie des structures importantes du corps, par exemple les plus pertinentes sont: l'hémoglobine et la myoglobine.
L'hémoglobine contient quatre chaînes de globine (Alfa 1 et Alfa 2) et (Beta 1 et Beta 2). Chaque globine a une réplication où elle protège le groupe Hemo.
D'un autre côté, il y a myoglobin. Qui a une structure moins complexe que l'hémoglobine. Cela présente un polypeptide globulaire à un seul strip.
Jusqu'à récemment, on croyait que c'était les seules substances qui contenaient la globine dans des êtres supérieurs, mais aujourd'hui, deux autres sont connus qui ont la globine dans leur constitution: la cytoglobine et la neuroglobine.
La cytoglobine est présente dans la plupart des tissus et est particulièrement située dans le tissu conjonctif, ainsi que dans la rétine.
À son tour, la neuroglobine a la préférence pour les tissus nerveux, d'où son nom. La neuroglobine a été trouvée dans les cellules nerveuses du cerveau situées au niveau du cortex cérébral, ainsi que dans d'autres endroits tels que le thalamus, l'hypothalamus, l'hippocampe et le cervelet.
Peut vous servir: taxonomie linnéenne des êtres vivantsCependant, ce ne sont pas les seuls endroits, car en dehors du système nerveux, il peut être trouvé dans les îlots de Langerhans du pancréas et dans la rétine.
Structure
Il existe 6 types de chaînes de globine désignées avec les lettres de l'alphabet grec: alpha (α), bêta (β), gamma (γ), delta (Δ), epsilon (ε) et zeta (ζ). Ces chaînes appartiennent à la famille des globinas, mais diffèrent les unes des autres dans le nombre d'acides aminés qu'ils possèdent.
Ces polypeptides ont une structure primaire, secondaire et tertiaire. La chaîne d'acides aminés simple représente la structure primaire. Lorsque la chaîne est roulée en formant des spirales ou des hélices constituent la structure secondaire.
Si cette structure se replie alors plusieurs fois sur elle-même, elle forme une structure globulaire correspondant à la structure tertiaire.
De même, ils ne peuvent acquérir la forme quaternaire que lorsque 4 molécules ou chaînes de globine sont combinées sous forme tertiaire.
Ceci est présenté dans la structure complexe de l'hémoglobine. Cependant, dans Myoglobin, c'est différent. Dans ce cas, la globine est présentée comme un monomère, c'est-à-dire qu'il a une seule chaîne peptidique qui est disposée en plis, créant 8 hélices (structure secondaire).
L'hémoglobine et la myoglobine abritent tous deux un groupe d'hémo à l'intérieur de leur structure complexe.
Hémoglobine
Dans cette molécule, 2 chaînes alpha globin et 2 chaînes bêta sont jointes. C'est ainsi qu'ils sont parfaitement couplés pour abriter le groupe Hemo en son centre, plus le fer.
Parmi ces structures, il y a des syndicats faibles et des syndicats forts. Dans les syndicats faibles, 19 acides aminés participent et l'Union se produit comme suit: La chaîne Alfa 1 rejoint la chaîne bêta 2 et la chaîne Alfa 2 rejoint la chaîne bêta 1.
Tandis que 35 acides aminés et les chaînes qui rejoignent sont: la chaîne Alfa 1 rejoint la chaîne bêta 1 et la chaîne Alfa 2 rejoint la chaîne bêta 2 2.
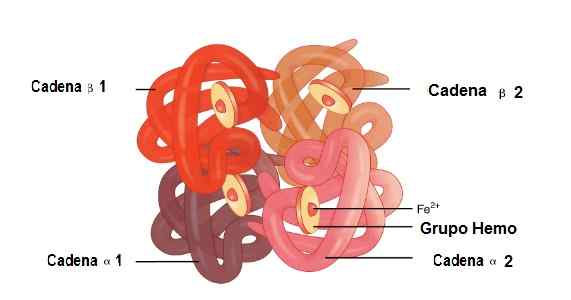 Emplacement des chaînes Alfa 1 et Alfa 2, Beta 1 et Beta 2 dans la structure de l'hémoglobine. Source: OpenX College [CC par 3.0 (https: // CreativeCommons.Org / licences / par / 3.0)] Image édité (traduite en espagnol)
Emplacement des chaînes Alfa 1 et Alfa 2, Beta 1 et Beta 2 dans la structure de l'hémoglobine. Source: OpenX College [CC par 3.0 (https: // CreativeCommons.Org / licences / par / 3.0)] Image édité (traduite en espagnol) Myoglobine
Dans la myoglobine, un groupe de protéines globulaires est également présent, mais dans ce cas, il existe une seule chaîne peptidique composée de 153 acides aminés. Sa disposition spatiale est secondaire et présente 8 hélices alpha.
Il peut vous servir: oligoations: à quoi servent-ils, à quoi servent-ils et que sontCette structure protéique place stratégiquement les acides aminés hydrophobes dans la structure, tandis que les acides aminés hydrophiles ou polaires se trouvent vers l'extérieur.
Ce design est parfait pour abriter le groupe Hemo à l'intérieur (partie hydrophobe). Cela se lie aux protéines par des liaisons non covalentes.
Cytoglobine
Il a été découvert en 2001 et il est dit qu'il s'agit d'un type d'hémoglobine, mais il diffère en ce qu'il est hexacoordonné, tandis que l'hémoglobine et la myoglobine sont pentacoordonnées. Cela a à voir avec la position adoptée par l'acide aminé histidine près du groupe Hemo.
Neuroglobine
Sa découverte a été faite en 2000. La neuroglobine est un monomère qui a 150 acides aminés, il est donc très similaire à la myoglobine. La structure de la neuroglobine a une similitude entre 21 et 25% avec la myoglobine et l'hémoglobine.
Les fonctions
Parce que la globine n'est pas seule dans le corps, mais faisant partie de certaines structures, les fonctions que chacune d'elles remplissent sont mentionnées:
Hémoglobine
Il est situé à l'intérieur des érythrocytes. Il est responsable de la fixation et du transport de l'oxygène des poumons aux tissus. Ainsi que le corps du dioxyde de carbone, faisant la route opposée.
Myoglobine
Le groupe Hemo situé dans la globine a la fonction de stocker des molécules d'oxygène pour oxygéner le muscle cardiaque et le muscle squelettique.
Cytoglobine
Cette protéine est censée influencer la protection de l'hypoxie et des états de stress oxydatif dans les tissus. On pense également que l'oxygène artériel peut transporter vers le cerveau.
Neuroglobine
On pense que la neuroglobine a la capacité de réparer l'oxygène, le monoxyde carbone et oxyde nitrique.
Cependant, on ne sait pas encore avec certitude quelle est la fonction de la neuroglobine, mais on pense qu'elle est liée à la régulation de l'hypoxie et de l'ischémie cérébrale. Surtout agirait comme un neuroprotecteur.
Peut vous servir: théorie de la transformation de LamarckParce que la neuroglobine a une structure similaire à l'hémoglobine et à la myoglobine, il est supposé qu'elle pourrait participer à l'approvisionnement en oxygène au niveau neuronal. On pense également qu'il peut éliminer les radicaux libres et l'azote qui se produisent dans la chaîne respiratoire.
En ce qui concerne l'oxyde nitrique, on pense qu'il l'éliminer lorsque l'oxygène est normal et le produit dans des processus d'hypoxie de non2.
Modifications
Les chaînes alpha et bêta de la globine sont codées par différents gènes situés sur les chromosomes 16 et 11.
Les personnes qui ont des hémoglobins (falciforme ou anémie drapanocytaire) ont un défaut dans la chaîne bêta de la globine. Le défaut consiste en un remplacement des bases d'azote au niveau du numéro de nucléotide 20 du gène impliqué, où il y a un changement d'adénine par un timin.
Mutations dans le gène βs du chromosome 11 provient différents halopes de globinas appelés: Sénégal, Cameroun, Benín, Bantú ou voiture et asiatique ou arabe-indien.
Connaître le type d'haplotype présenté par des patients atteints d'anémie falciforme est une importante épidémiologique, car elle permet de connaître la distribution de différents haplotypes, mais cette information fournit également des données importantes pour connaître le pronostic de la maladie.
Par exemple: il est connu que le halotype bantu est plus grave, tandis que le type Sénégal et asiatique sont plus doux.
Les différences entre un haplotype et un autre se trouvent dans la quantité d'hémoglobine F qu'ils possèdent. Un pourcentage plus élevé d'hémoglobine F et de mieux le pronostic de l'hémoglobine inférieure. Moins d'hémoglobine F et plus d'hémoglobine S Pire pronostic.
Ces mutations sont héréditaires autosomiquement avec la mutation de l'hémoglobine S.
Les références
- "Globin." Wikipedia, encyclopédie gratuite. 19 octobre 2018, 13:44 UTC. 11 juillet 2019, 17:26, Wikipedia.org
- «Myoglobin." Wikipedia, encyclopédie gratuite. 7 juillet 2019, 21:16 UTC. 11 juillet 2019, 20:42, Wikipedia.org
- Durán C, Morales O, Echeverri S, Isaza M. Halotypes du gène de la globine bêta chez les porteurs d'hémoglobine en Colombie. Biomedical 2012; 32: 103-111. Disponible sur: SCIELO.org
- Forrellat M, Hernández P. Neuroglobine: nouveau membre de la famille Globinas. Cuban Rev Immunol Hemother 2011; 27 (3): 291-296. Disponible sur: SCIELO.SLD
- «Cytoglobin." Wikipedia, encyclopédie gratuite. 1 septembre 2017, 17:26 UTC. 12 juillet 2019, 00:28 Wikipedia.org
- « Caractéristiques des hétéropolysaccharides, structure, fonctions
- Symptômes, causes et traitements de la schizophrénie paranoïde »

