Gilbert Newton Lewis
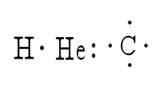
- 2676
- 302
- Eva Henry
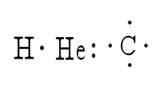 Gilbert Newton Lewis
Gilbert Newton Lewis Gilbert Newton Lewis (1875-1946) était l'un des scientifiques américains les plus importants du XXe siècle. Son travail a produit une révolution structurelle dans les études chimiques, grâce aux multiples contributions qu'il a apportées tout au long de sa vie pour le développement de la science.
Parmi les contributions de ce physicochimique se distinguent la formule qui porte son nom, avec lequel les paires d'électrons sont représentées graphiquement. Les travaux de recherche de Lewis étaient très larges, bien que sa renommée soit essentiellement due à la théorie des liaisons chimiques et à la définition de l'acide acide-base en 1923.
Lewis a eu une grande influence sur le monde scientifique et académique des États-Unis, en particulier à l'Université de Harvard, où le président a été formé et dicté. Son travail pour l'armée américaine pendant la Première Guerre mondiale lui a valu la plus grande reconnaissance et les plus hauts honneurs.
Il a été formé dans les universités du Nebraska, Harvard, Leipzig et Gontinga en Allemagne. Il a travaillé au Massachusetts Institute (MIT), à l'Université Harvard et à l'Université de Californie, où il est décédé en travaillant.
Tout au long de sa vie, il a reçu une innombrable reconnaissance et des récompenses, parmi lesquelles plusieurs honors doctorants à Chicago, Madrid, Liverpool, Wisconsin et Pennsylvanie se démarquent. Il était membre honoraire de plusieurs institutions scientifiques en Angleterre, en Inde, en Suède, au Danemark et aux États-Unis.
Biographie
Naissance et premières années
Gilbert Newton Lewis est né à Weymouth, Massachusetts, le 23 octobre 1875. Ses parents étaient Frank Wesley Lewis et Mary Burr White Lewis. Au cours de ses premières années, il a reçu des enseignements chez lui et à 10 ans, il est entré à l'école publique, où il a obtenu son diplôme en 1889.
En 1884, Lewis a dû s'installer avec sa famille à Lincoln, Nebraska. À 13 ans, il a été admis au lycée de l'Université du Nebraska.
Peut vous servir: Beryllium Hydrure (BEH2)Études
Quand il a obtenu son diplôme, il a poursuivi ses études universitaires pendant deux ans, puis s'est inscrit à l'Université Harvard en 1893.
Au départ, il s'intéressait à l'économie, mais a finalement opté pour la physique et la chimie. Gilbert a obtenu son titre en chimie en 1896 et pendant un an, il enseignait à la Phillips Academy, une école privée pour Andover.
Il est retourné à Harvard pour faire le poste de troisième cycle et obtenir la maîtrise en 1898 avec sa thèse sur L'électron et une molécule. Un an plus tard, le doctorat et sa thèse étaient intitulés Certaines relations électrochimiques et thermochimiques des amalgammes de zinc et de cadmium".
À Harvard, il a été instructeur pendant un an, puis s'est rendu en Europe avec une bourse. Il a étudié avec les grands physicochimiques de l'époque.
En 1899, il s'est rendu en Allemagne pour étudier avec Wilhelm Ostwald Leipzig puis avec Walter Nernst à l'Université de Gontinga; Puis il a travaillé pour le gouvernement philippin.
Travail académique et participation à la guerre
Entre 1999 et 1906, il a publié une présidente de chimie à l'Université Harvard puis embauché par le Massachusetts Institute of Technology, où il était de 1907 à 1912.
Plus tard, il est devenu professeur de chimie physique à l'Université de Californie (Berkeley), où il a obtenu le degré de doyen de l'École de chimie.
En 1908, il a publié son premier article sur la théorie de la relativité en parallélisme avec Albert Einstein. En cela, il établit qu'il existe un lien entre l'énergie-masa, mais dans une direction autre que celle employée par Einstein.
Le 21 juin 1912, Lewis a épousé Mary Fanckley Sheldon, avec qui il a eu trois enfants: Margery S. Lewis, Edward S. Lewis et Richard Newton Lewis.
Il peut vous servir: acide gibère: caractéristiques, synthèse, fonctionsSon travail en Californie a été interrompu par le déclenchement de la Première Guerre mondiale. En 1917, il a été chargé de travailler pour l'armée américaine, où il est devenu chef de la division de la défense du service de guerre chimique.
La livraison et la capacité de travail de Lewis ont permis à l'armée. À la fin de la guerre, il a été récompensé pour ses services avec les plus hauts honneurs.
Décès en laboratoire
Gilbert N. Lewis est décédé à 70 ans pour une crise cardiaque lorsqu'il travaillait dans son laboratoire de l'Université de Berkeley, le 23 mars 1946.
Peut-être en raison de sa personnalité introvertie, cet éminent scientifique n'a jamais reçu le prix Nobel. Presque à la fin de sa carrière, il a réussi à prouver que la phosphorescence des molécules organiques est régie par un État triplet excité, calculant même ses propriétés magnétiques.
Contributions à la science
Certaines des contributions les plus importantes de Gilbert Newton Lewis à la science sont les suivantes:
Structures de Lewis
Ce sont plusieurs méthodes qui servent à représenter la structure d'une molécule. Dans ces symboles des éléments représentent les atomes, tandis que les points représentent les électrons qui les entourent. Un exemple de cela est la représentation de l'hydrogène, de l'hélium et du carbone:
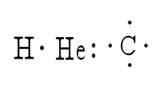
Lewis a été le premier à proposer l'idée que les atomes pouvaient rester unis en comparant les paires d'électrons; C'est pourquoi il a créé le symbolisme des structures.
La théorie des liens larges proposée par Lewis a servi à se regrouper dans un concept tous les types de liens chimiques. De cette façon, les relations entre les substances ioniques, moléculaires, covalentes et métalliques ont été démontrées. Jusque-là, ces éléments n'avaient eu aucune connexion conceptuelle.
Peut vous servir: type de lien de 02Une liaison covalente
Conceptualisé la liaison covalente qui forme entre deux atomes lorsqu'ils se joignent pour atteindre des octets stables et partager des électrons du dernier niveau, à l'exception de l'hydrogène, qui parvient à atteindre la stabilité en ayant 2 électrons.
Théorie des octets
Il a été indiqué par Lewis en 1916. Cela établit que les ions appartenant aux éléments du système périodique ont tendance à compléter avec un certain nombre de 8 électrons leurs derniers niveaux d'énergie. Cela leur permet d'acquérir une configuration très stable.
Photon
C'était le créateur en 1926 du terme photon pour désigner la plus petite unité d'énergie lumineuse. Cette particule d'énergie transmet toutes les formes existantes de rayonnement électromagnétique (rayons x, infrarouge, gamma, ultraviolet, micro-ondes, ondes radio, etc.).
Attraction chimique et Valence
Avec son collègue chimique Irwing Langmir, il a développé la théorie de l'attraction et de la valence chimique, connue sous le nom de théorie de Langmuir-Lewis. Pour cela, il était basé sur la structure atomique des substances.
Eau lourde
Lewis a également été le premier scientifique à étudier et à produire de l'eau lourde (deutérium) dans sa forme la plus pure. Il a également été le premier à appliquer les principes de la thermodynamique dans l'étude des problèmes chimiques.
Théorie de la dissolution
De même, Lewis est reconnu son travail sur la théorie des solutions; c'est-à-dire les mélanges homogènes obtenus à partir de l'interposition d'atomes, molécules ou ions présents dans deux ou plusieurs substances. Ces substances appelées composants interviennent dans des proportions qui varient.

