Formule semi-développée ce qui est et des exemples (méthane, propane, butane ...)
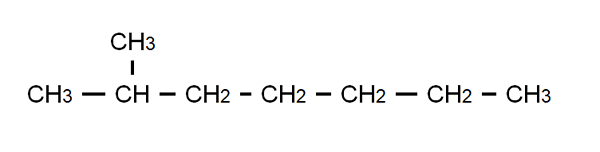
- 1182
- 234
- Raphaël Charles
La Formule semi-développée, Également connu sous le nom de formule semi-structurale, c'est l'une des nombreuses représentations possibles qui peuvent être données à la molécule d'un composé. Il est très récurrent en chimie organique, en particulier dans les textes académiques, car avec lui, l'ordre correct d'une molécule et de ses liaisons covalentes est montrée.
Contrairement à la formule développée, qui devient la même que la formule structurelle, elle ne montre pas les liaisons C-H, en les omettant de simplifier la représentation. De cette formule, tout lecteur sera en mesure de comprendre ce qu'est le squelette d'une molécule; Mais pas sa géométrie ni aucun des aspects stéréochimiques.
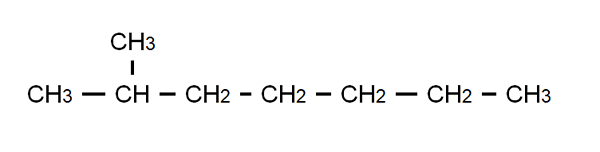 Formule semi-développée du 2-méthylheptano. Source: Gabriel Bolívar.
Formule semi-développée du 2-méthylheptano. Source: Gabriel Bolívar. Pour clarifier ce point, nous avons la formule semi-développée du 2-méthylheptano: un alcane ramifié dont la formule moléculaire est C est8H18, et qui obéit à la formule générale CnH2n + 2. Notez que la formule moléculaire ne dit absolument rien sur la structure, tandis que le semi-développé permet de visualiser quelle est cette structure.
De même, notez que les liaisons C-H sont omises, mettant en évidence uniquement les liaisons C-C qui composent la chaîne ou le squelette gazéifiés. On verra que pour les molécules simples, la formule développée coïncidera avec la formule condensée; Et même, avec moléculaire.
[TOC]
Exemples
Méthane
La formule moléculaire du méthane est Cho4, Eh bien, il a quatre liens C-H et est une géométrie tétraédrique. Ces données sont fournies par la formule structurelle avec des coins à l'extérieur ou en dessous de l'avion. Pour le méthane, la formule condensée devient également CHO4, Comme empirique et semi-développé. C'est le seul composé pour lequel ladite singularité est accomplie.
La raison pour laquelle la formule semi-développée de méthane est Cho4, C'est parce que leurs liens C-H ne sont pas écrits; Pour ce faire, cela correspondrait à la formule structurelle.
Peut vous servir: solvatationPropane
La formule semi-développée de propane est Cho3-Ch2-Ch3, Avoir seulement deux liens C-C. Sa molécule est linéaire, et si elle le montre, sa formule condensée est exactement la même: Cho3Ch2Ch3, Avec la seule différence que les liens C-C sont omis. Pour le propane, il est réalisé que la formule semi-développée et condensée coïncide.
En fait, cela est accompli pour tous les alcanes de chaînes linéaires car elle continuera d'être vue dans les sections suivantes.
Butane
La formule butane semi-développée est Cho3-Ch2-Ch2-Ch3. Notez qu'il peut être écrit dans la même ligne. Cette formule à proprement parler correspond à celle du n-butane, indiquant que c'est l'isomère linéaire et effronté. L'isomère ramifié, le 2-méthylpropane, vient d'avoir la formule semi-développée suivante:
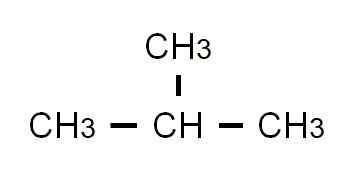 Formule semi-développée de 2-méthylpropane. Source: Gabriel Bolívar.
Formule semi-développée de 2-méthylpropane. Source: Gabriel Bolívar. Cette fois, il ne peut plus être écrit ou représenté dans la même ligne. Ces deux isomères partagent la même formule moléculaire: C4Hdix, qui ne sert pas à se distinguer les uns des autres.
Pentano
Nous avons à nouveau un autre alcane: le pentan, dont la formule moléculaire est C5H12. La formule semi-développée du n-Pentano est ch3-Ch2-Ch2-Ch2-Ch3, Facile à représenter et à interpréter, sans avoir besoin de placer les liens C-H. Les groupes ch3 Ce sont le méthyle ou le méthyle si appelé, et les Choons2 Ce sont du méthylène.
Le pentan a d'autres isomères structurels ramifiés, qui sont observés dans l'image inférieure représentée par leurs formules semi-développées respectives:
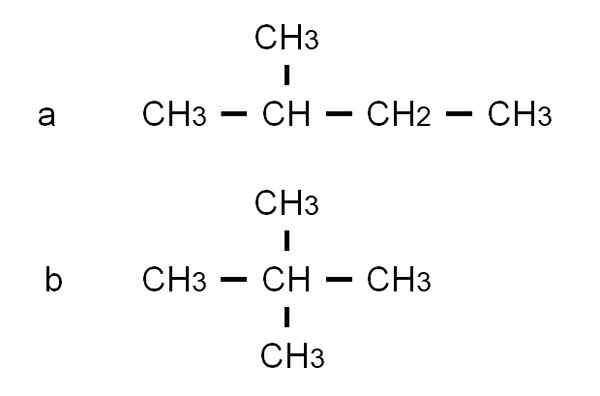 Formules semi-développées des deux isomères ramifiés du pentan. Source: Gabriel Bolívar.
Formules semi-développées des deux isomères ramifiés du pentan. Source: Gabriel Bolívar. L'isomère pour C'est le 2-méthylbutane, également appelé isopentano. Pendant ce temps, l'isomère b Il est de 2,2-diméthylpropane, également connu sous le nom de Neopentano. Ses formules semi-développées font clairement la différence entre les deux isomères; Mais il ne dit pas grand-chose sur l'apparence de telles molécules dans l'espace. Pour ce faire, des formules structurelles et des modèles prendraient.
Peut vous servir: acide sulfonique: structure, nomenclature, propriétés, utilisationsÉthanol
Les formules semi-développées sont non seulement utilisées pour les alcanes, les alcènes ou les alcynes, mais pour tout type de composé organique. Ainsi, l'éthanol, un alcool, a une formule semi-développée: ch3-Ch2-Oh. Notez qu'un lien C-O est maintenant représenté, mais pas le lien O-H. Toutes les liaisons hydrogène sont méprisées.
Les alcools linéaires sont faciles à représenter comme des alcanes. En résumé: toutes les formules semi-développées de molécules linéaires sont faciles à écrire.
Diméthyléter
Les éthers peuvent également être représentés avec des formules semi-développées. Dans le cas du diméthyléter, dont la formule moléculaire est C2H6Ou, le semi-développé est: Cho3-O-ch3. Notez que le diméthyléter et l'éthanol sont des isomères structurels, car ils partagent la même formule moléculaire (dites les atomes de C, H et O).
Cyclohexan
Les formules semi-développées pour les composés ramifiées sont plus fastidieuses à représenter que linéaires; Mais il y a encore plus de composés cycliques, comme le cyclohexan. Sa formule moléculaire lui correspond comme pour hexène et ses isomères structurels: c6H12, Puisque l'anneau hexagonal compte comme une insaturation.
Pour représenter le cyclohexan, un anneau hexagonal est dessiné aux sommets duquel les groupes de méthylène seront situés, ch2, Tout comme ci-dessous:
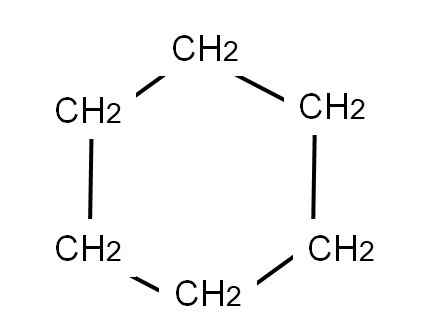 Formule semi-développée du cyclohexan. Source: Gabriel Bolívar.
Formule semi-développée du cyclohexan. Source: Gabriel Bolívar. La formule développée du cyclohexane montrerait les liens C-H, comme si l'anneau avait des «antennes» de la télévision.
Acide phosphoreux
La formule moléculaire de l'acide phosphoreuse est H3Pote3. Pour de nombreux composés inorganiques, la formule moléculaire est suffisante pour avoir une idée de la structure. Mais il y a plusieurs exceptions, et c'est l'un d'eux. Avec le fait que H3Pote3 C'est un acide diprotique, la formule semi-développée est: HPO (OH)2.
Peut vous servir: Neopentil: structure, caractéristiques, nomenclature, formationC'est-à-dire que l'un des hydrogènes est directement lié à l'atome de phosphore. Cependant, formule H3Pote3 Il admet également une molécule avec une formule semi-développée: PO (OH)3. Les deux sont, en fait, ce qui est connu par les tautomères.
Les formules semi-développées en chimie inorganique sont très similaires à celles condensées en chimie organique. Dans les composés inorganiques, pour ne pas avoir de liaisons C-H, et pour être plus simples, leurs formules moléculaires suffisent généralement à les décrire (lorsqu'ils sont des composés covalents).
Commentaire général
Les formules semi-développées sont très courantes lorsque l'élève apprend les règles de la nomenclature. Mais une fois assimilé, en général, les notes de chimie sont encombrées de formules structurelles squelettiques; Autrement dit, non seulement les liens C-H sont omis, mais économisent également du temps lors de l'ignorer le C.
Pour le reste, en chimie organique, les formules condensées sont plus récurrentes que celles semi-développées, car les premiers n'ont même pas besoin d'écrire les liens comme dans le second. Et en ce qui concerne la chimie inorganique, ces formules semi-développées sont moins utilisées.
Les références
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning.
- Wikipédia. (2020). Formule semi-développée. Récupéré de: est.Wikipédia.org
- Siyavula. (s.F.). Structures moléculaires organiques. Récupéré de: Siyavula.com
- Jean Kim et Kristina Bonnett. (5 juin 2019). Dessin de structures organiques. CHIMISTER BOOLISTexts. Récupéré de: Chem.Bibliothèque.org
- Enseignants. Marl et JLA. (s.F.). Introduction aux composés de carbone. [PDF]. Récupéré de: IPN.mx
- « Consommation durable pour ce qui est l'utilisation, l'importance, les actions, les exemples
- Caractéristiques et exemples de réaction réversibles »

