Structure du phosphate de sodium, propriétés, synthèse, utilisations

- 3631
- 178
- Prof Ines Gaillard
Il Phosphate de sodium C'est un sel inorganique dont la formule chimique est na3Pote4. Il reçoit également des noms de phosphate trisodifs (TSP pour son acronyme en anglais: Phosphate trisodique), ou phosphate de sodium tribasique, car il n'a pas complètement la capacité de donner des ions hydrogène H+.
Lorsque vous y faisiez allusion au pluriel, les phosphates de sodium, il est question de l'ensemble du recueil de sels, hydraté ou non, provenant d'interactions électrostatiques entre NA+ et le po43-. Certains de ces sels sont même constitués de pyrophosphates de sodium ou de polymères inorganiques qui possèdent le PO43- comme monomère.
 Verre d'horloge avec des cristaux de phosphate de sodium. Source: Ondřej Mancgl [domaine public]
Verre d'horloge avec des cristaux de phosphate de sodium. Source: Ondřej Mancgl [domaine public] C'est pourquoi, à moins qu'une spécification ne soit faite, elle se réfère toujours à Na3Pote4, Et pas à non2PO4, na2HPO4, N / A4P2SOIT7 Pas d'autre sel.
L'image supérieure montre l'apparition du phosphate de sodium, qui ressemble à des cristaux blancs similaires à ceux du sel ou de la table commun, ou acheté comme une poudre amorphe blanche. Puis un3Pote4 est capable de former plusieurs hydrates, étant le na3Pote4· 12h2Ou celui qui est le plus commercialisé.
Il trouve une utilisation principalement dans l'industrie alimentaire, dans les détergents, les suppléments sportifs et sert de laxatif hyperosmotique.
[TOC]
Structure chimique
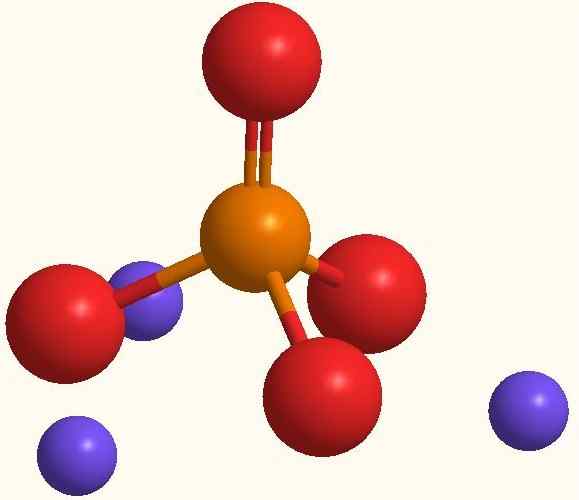 Ions principaux du phosphate de sodium. Source: Smolamj via Wikipedia.
Ions principaux du phosphate de sodium. Source: Smolamj via Wikipedia. La même formule NA3Pote4 indique que pour chaque anion po43- Il y a trois cations nautiques+. Ces ions peuvent être observés dans l'image supérieure. Notez que le po43- Il a une géométrie tétraédrique, ses atomes d'oxygène portant une charge négative résonnante, qui attire le NA+ de l'environnement.
Aussi, la formule NA3Pote4 Il souligne que c'est du sel anhydre, donc il n'y a pas de molécules d'eau incluses dans leurs cristaux. Attractions électrostatiques entre NA+ et le po43- Ils finissent par définir un cristal blanc trigonal. Son lien ionique est tel que le na3Pote4 Il a un point de fusion de 1583 ºC, considérablement supérieur à celui de plusieurs sels.
Peut vous servir: Réaction de Cannizzaro: caractéristiques, mécanismes, exemplesLes deux+ Comme po43- Ce sont des ions qui peuvent être hydratés dans le haut degré, sans avoir un impact négatif sur la stabilité des cristaux.
C'est pour cette raison que les hydrates peuvent également cristalliser; Cependant, ses points de fusion sont inférieurs à ceux du sel anhydre, car les ponts hydrogène intermoléculaires de l'eau séparent les ions et affaiblissent leurs interactions. Dans le na3Pote4· 12h2Ou, par exemple, son point de fusion est de 73,4 ºC, beaucoup moins que celui de Na3Pote4.
Propriétés
Apparence physique
Il peut se produire comme des cristaux blancs définis ou comme une poussière ou des granules de la même couleur. Toutes les amplitudes physiques exprimées ci-dessous ne font allusion qu'au sel naïf3Pote4.
Point de fusion
1583 ºC
Point d'ébullition
100 ºC
Solubilité dans l'eau
14,5 g / 100 ml à 25 ° C, il est donc considéré comme un phosphate d'eau assez soluble. Cependant, il est insoluble dans des solvants organiques tels que l'éthanol et le disulfure de carbone.
Densité
2 536 g / cm3 à 17,5 ºC.
La stabilité
C'est un solide hygroscopique. Par conséquent, il doit être stocké de telle manière qu'il ne peut pas être exposé à l'humidité.
pH
C'est un sel fortement alcalin. Par exemple, une solution aqueuse de 0,1% a déjà un pH 11,5. Cette propriété sert à être utilisée comme additif dans les détergents.
La synthèse
Comment le phosphate de sodium est-il produit ou synthétisé? Pour ce faire, il est basé sur l'acide phosphorique, H3Pote4, ou à partir de phosphate de sel de sodium de sel, non2Pote4.
Dans la grande majorité de la synthèse, H est préféré3Pote4. Ainsi, le H est réagi3Pote4 Avec une base qui neutralise ses trois groupes OH, en tenant compte que cet acide peut également être écrit comme PO (OH)3.
Peut vous servir: équilibre des sujets: ce qui est, l'équation générale, les typesLa base par préférence est l'hydroxyde de sodium, NaOH (en Allemagne), mais il est également viable (et moins cher) d'utiliser du carbonate de sodium ou des cendres de Sosa, Na2CO3 (aux Etats-Unis). Les équations pour les deux réactions de neutralisation sont:
N / A2CO3 + H3Pote4 → Na2HPO4 + CO2 + H2SOIT
N / A2HPO4 + NaOH → Na3Pote4 + H2SOIT
Notez que lorsque vous utilisez le na2CO3 Na n'est pas obtenu3Pote4 Mais le na2HPO4, qui nécessitera une neutralisation ultérieure. Être la réaction aqueuse signifie, cristallise le na3Pote4· 12h2Ou, il doit donc être calculé pour éliminer sa teneur en eau et provoquer un sel anhydre.
Puis un3Pote4· 12h2O Il se caractérise par la «fusion» de leurs cristaux dans une masse compacte difficile. Plus la taille de leurs cristaux est petite, plus sa calcination sera rapide.
Applications
Nourriture
 Le phosphate de sodium est utilisé comme agent effervescent pour étendre les rôles ou les gâteaux de cannelle. Source: Pixabay.
Le phosphate de sodium est utilisé comme agent effervescent pour étendre les rôles ou les gâteaux de cannelle. Source: Pixabay. Dans le sodium, le phosphate utilise, il est inévitable pour mélanger le na3Pote4 ou na3Pote4· 12h2Ou, parce que ce dernier est l'hydrate qui est le plus commercialisé. Par exemple, l'un des deux fournit des ions inoffensifs (en théorie) à la nourriture à laquelle ils sont ajoutés, en les enrichissant de phosphates et en même temps augmenter leur salinité.
Dans le salaire des viandes, le na3Pote4· 12h2Ou est inclus pour les garder frais plus longtemps pendant leur stockage. Il est également ajouté en tant qu'agent émulsifiant afin que le mélange d'huile d'huile ne soit pas "coupé", mais reste unis; Et en tant que régulateur de pH, car il aide à réduire l'acidité des aliments (y compris les céréales).
Peut vous servir: Silicate de calcium: propriétés, structure, obtenir, utiliserDe plus, il est utilisé pour épaissir certaines sauces de tomate et pour la cuisson du gâteau ou du pain (image supérieure). Ce dernier est parce que le na3Pote4· 12h2Ou a tendance à libérer de la vapeur d'eau, ce qui augmente la taille des pores de la masse de farine et le volume du même.
Détergents
Le phosphate de sodium est suffisamment basique pour saponifier certaines graisses ou huiles avec lesquelles vous avez un contact. Son alcalinité est ensuite utilisée pour améliorer l'action des détergents, tant que la surface de la misère n'est pas du métal, car ils peuvent le détériorer.
Cependant, la production de détergents enrichie de phosphates a été réduite car ils produisent l'eutrophisation des lacs et des rivières et, avec lui, la prolifération des algues qui couvre leurs surfaces.
Il a également été utilisé pour l'élaboration d'un désinfectant: na3Pote4· 1/4naocl · 11h2Ou, qui est préparé à l'aide d'hypochlorite de sodium, NaOCL, au lieu de NaOH ou Na2CO3 Pour neutraliser h3Pote4.
Médicinal
Puis un3Pote4 Il induit une défécation en agissant comme un laxatif hyperosmotique, nécessaire pour nettoyer le côlon avant que le patient ne subisse une coloscopie. D'un autre côté, il a également été utilisé (ajouté) dans les suppléments d'énergie.
Les références
- Fhiver & Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Centre national d'information sur la biotechnologie. (2019). Phosphate trisodique. Base de données PubChem. CID = 24243. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement
- Wikipédia. (2019). Phosphate trisodique. Récupéré de: dans.Wikipédia.org
- Curran M.P. & Plosker G.L. (2004). Solution de phosphate de sodium oral: une revue de ses utilisations pour le nettoyant colorectal. Doi: 10.2165 / 00003495-200464150-00009
- Corey Whelan. (22 décembre 2017). Phosphate de sodium. Récupéré de: Healthline.com
- Jacobs, Joel B. Taborosi, Steve. (2019). Processus pour la production de phosphate de trisodium. Récupéré de: FreepatentsSonline.com
- Marques Maryann. (2018). Pourquoi le phosphate de trisodium (TSP) est-il ajouté à notre nourriture? Récupéré de: TheingredientGuru.com
- « Astrocytes histologiques, fonctions, types
- Caractéristiques de pseudocode, structure, applications »

