Structure et fonctions de la fibronectine
- 2080
- 93
- Raphaël Meyer
La fibronectine Il s'agit d'une classe de glycoprotéine qui appartient à la matrice extracellulaire. Ce type de protéine est généralement responsable de la liaison ou de la liaison de la membrane cellulaire aux fibres de collagène trouvées à l'extérieur.
Le nom "fibronectine" vient d'un mot composé de deux mots en latin, le premier est "fibre" ce qui signifie la fibre ou le filament et, le second "Necter" Qu'est-ce qui signifie connecter, lier, coller ou flirter.
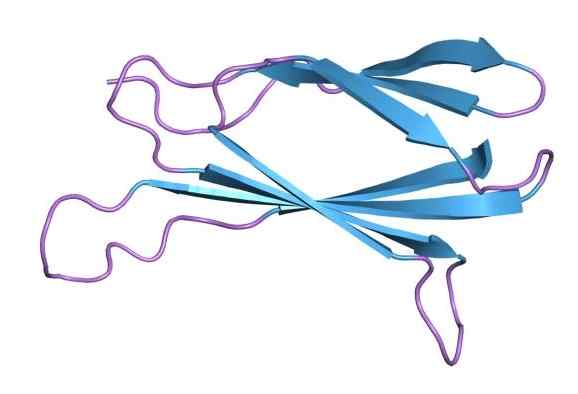
 Structure moléculaire de la fibronectine (Source: Jawahar Swaminathan et MSD Staff au European Bioinformatics Institute [Domain public] via Wikimedia Commons)
Structure moléculaire de la fibronectine (Source: Jawahar Swaminathan et MSD Staff au European Bioinformatics Institute [Domain public] via Wikimedia Commons) La fibronectine a été visualisée pour la première fois en 1948 en tant que polluant de fibrinogène préparé par le processus de fractionnement de l'éthanol froid de Cohn. Cela a été identifié comme une glycoprotéine plasmatique unique qui possédait les caractéristiques d'une globuline insoluble au froid.
Cette protéine a un poids moléculaire élevé et a été liée à une grande variété de fonctions à l'intérieur des tissus. Parmi eux se trouve l'adhésion entre la cellule et la cellule, l'organisation du cytosquelette, la transformation oncogène, entre autres.
La fibronectine est répartie par de nombreuses parties du corps par sa forme soluble dans le plasma sanguin, le liquide céphaloral, le liquide synovial, le liquide amniotique, le liquide séminal, la salive et les exsudats inflammatoires.
Les chercheurs ont signalé que les concentrations plasmatiques de fibronectine augmentent lorsque les femmes enceintes souffrent de pré-plalassia. Ainsi, cette augmentation de la concentration de fibronectine a été incorporée par des spécialistes pour diagnostiquer les patients, cette condition.
[TOC]
Structure
Les fibronectines sont de grandes glycoprotéines, qui ont un poids moléculaire d'environ 440 kDa. Ils sont composés d'environ 2.300 acides aminés, qui représentent 95% de la protéine, car les 5% autres sont des glucides.
Il peut vous servir: cellules enterocromofines: histologie, fonctions, maladiesLes différentes analyses qui ont été effectuées sur la séquence génomique et transcriptomique (ARN messager) de la protéine ont indiqué que cela est composé de trois blocs de séquences homologues répétées, avec des longueurs de 45, 60 et 90 acides aminés chacun.
Les trois types de séquences représentent plus de 90% de la structure totale des fibronectines. Les séquences homologues de type I et II sont des boucles uni par les ponts disulfure. Ces boucles contiennent respectivement 45 et 60 déchets d'acides aminés,.
Les séquences homologues de type III correspondent à 90 acides aminés commandés en ponts linéaires et sans disulfure à l'intérieur. Cependant, certains des acides aminés internes des séquences homologues de type III ont des groupes de sulfure libres (R-S-H).
Les trois séquences homologues se replient et s'organisent dans une matrice plus ou moins linéaire pour former deux "bras dimiques" de sous-unités protéiques presque identiques. Les différences entre les deux sous-unités découlent d'événements de maturation post-transcriptifs.
Les fibronectines peuvent généralement être observées de deux manières. Une forme ouverte observée lorsqu'elle est déposée à la surface de la membrane et qui est prête à relier un autre composant extérieur cellulaire. Cette forme n'est observée qu'en microscopie électronique.
L'autre façon peut être vue dans les solutions physiologiques. Les extrémités de chaque bras ou extension sont pliées vers le centre de la protéine, se joignant aux extrémités carboxyles des sites de liaison au collagène. De cette façon, la protéine a une apparence globulaire.
Domaines et propriétés de "multiadhésion"
Les propriétés de la multiadhésion de la fibonectine proviennent de la présence de différents domaines qui ont des valeurs d'affinité élevées pour différents substrats et protéines.
Peut vous servir: récepteurs membranaires: fonctions, types, comment ils fonctionnentLes "armes Dimérica" peuvent être divisées en 7 domaines fonctionnels différents. Ceux-ci sont classés en fonction du substrat ou du domaine auquel chacun rejoint. Par exemple: le domaine 1 et le domaine 8, sont des domaines de l'union à la protéine de fibrine.
Le domaine 2 possède des propriétés de liaison au collagène, le domaine 6 est une région d'adhésion cellulaire, c'est-à-dire qu'elle lui permet d'être ancrée dans presque toutes les membranes ou surface externe des cellules. Les fonctions des domaines 3 et 5 sont encore inconnues aujourd'hui.
Dans le domaine 9, l'extrémité carboxyle ou C-terminal de la protéine est située. Les régions d'adhésion des cellules du domaine maman 6 ont le tripéptide constitué par la séquence d'acides aminés arginine-glycine-asparagine (arg-gly-asp).
Ce tript est partagé par plusieurs protéines telles que le collagène et les intégrines. Il en va de même pour la structure minimale requise pour la reconnaissance de la membrane plasmique par les fibronectines et les intégrines.
La fibronectine, lorsqu'elle est sous sa forme globulaire, représente une forme soluble et libre dans le sang. Cependant, sur les surfaces cellulaires et dans la matrice extracellulaire, il est sous forme "ouverte", rigide et insoluble.
Les fonctions
Certains des processus dans lesquels la participation des fibronectines sont l'union de la cellule à la cellule, la jonction, la connexion ou l'adhésion cellulaire au plasma ou aux membranes basales, la stabilisation des caillots sanguins et la cicatrisation des plaies.
Les cellules adhèrent à un site spécifique de la fibronectine à travers une protéine de réception appelée "intégrine". Cette protéine traverse la membrane plasmique à l'intérieur de la cellule.
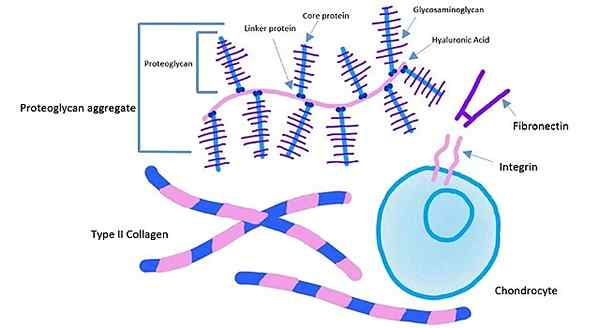 Composants de la matrice extracellulaire du tissu cartilagineux (Source: Kassidy Veasaw [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)] via Wikimedia Commons)
Composants de la matrice extracellulaire du tissu cartilagineux (Source: Kassidy Veasaw [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)] via Wikimedia Commons) Le domaine extracellulaire des intégrines se lie à la fibronectine, tandis que le domaine intracellulaire des intégrines est adhéré aux filaments d'actine. Ce type d'ancrage vous permet de transmettre la tension générée dans la matrice extracellulaire au cytosquelette des cellules.
Il peut vous servir: smozyme: caractéristiques, structure, fonctionsLes fibronectines participent au processus de cicatrisation des plaies. Ceux-ci, sous leur forme soluble, sont déposés sur les fibres de collagène adjacentes à la plaie, aidant la migration des phagocytes, des fibroblastes et de la prolifération cellulaire dans la plaie ouverte.
Le processus de guérison réel commence lorsque les fibroblastes "tournent" le réseau de fibronectine. Ce réseau agit comme une sorte d'échafaudage ou de soutien aux nouvelles fibres de collagène à déposer, sulfate Heparán, protéoglican.
La fibronectine est également impliquée dans le mouvement des cellules épidermiques, car par le tissu granulaire, il aide à réorganiser la membrane basale sous l'épiderme dans les tissus, ce qui aide à se produire la kératinisation.
Toutes les fibronectines ont des fonctions indispensables pour toutes les cellules; Ils participent à des processus aussi divers que la migration et la différenciation cellulaire, l'homéostasie, la phagocytose de la cicatrisation des plaies, entre autres.
Les références
- Conde-Agudelo, un., Romero, R., & Roberts, J. M. (2015). Tests pour prédire la prééclampsie. Dans les troubles hypertendus de Chesley pendant la grossesse (PP. 221-251). Presse universitaire.
- Farfán, J. POUR. L., Tovar, h. B. S., de promenade, m. D. R. g., & Guevara, c. g. (2011). Fibronectine fœtale et longueur cervicale comme prédicteurs précoces de l'accouchement prématuré. Gynécologie et obstétrique du Mexique, 79 (06), 337-343.
- Feist, e., & Hiepe, f. (2014). Auto-anticorps de fibronectine. En auto-anticorps (pp. 327-331). Elsevier.
- Letourneau, P. (2009). PATHING AXONAL FINDING: Rôle matriciel extracellulaire. Encyclopédie des neurosciences, 1, 1139-1145.
- Pankov, R., & Yamada, k. M. (2002). Fibronectine en un coup d'œil. Journal of Cell Science, 115 (20), 3861-3863.
- Proctor, R. POUR. (1987). Fibronectine: un bref aperçu de sa structure, de sa fonction et de sa physiologie. Revues de facilité infectieuse, 9 (Supplement_4), S317-S321.
- « Caractéristiques et fonctions des condroblastes
- Caractéristiques de topo grillo, habitat, distribution, plats, contrôle »

