Fonction du fibrinogène, concentrations élevées et faibles, valeurs normales
- 4111
- 741
- Jade Duval
Il fibrinogène C'est une glycoprotéine plasmatique qui, lorsqu'elle est coupée par une enzyme connue sous le nom de thrombine, est transformée en fibrine, l'un des composants protéiques les plus abondants qui forme des caillots sanguins (c'est l'un des 13 facteurs impliqués dans la coagulation sanguine)).
Il s'agit d'une grande protéine, car elle pèse environ 340 kDa et est composée de deux "blocs" moléculaires symétriques, chacun formé par trois chaînes polypeptidiques différentes et polymorphes appelées Aα, Bβ et γ, qui sont jointes de manière covalente entre 29 via 29 ponts disulfure.
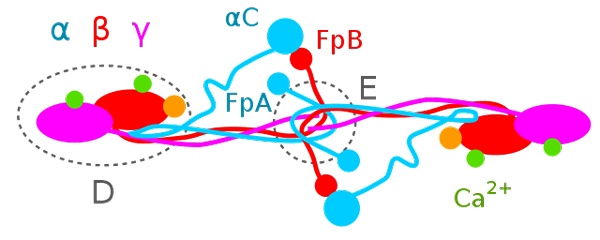
 Schéma structurel du fibrinogène humain (source: 5-HT2AR [CC0] via Wikimedia Commons)
Schéma structurel du fibrinogène humain (source: 5-HT2AR [CC0] via Wikimedia Commons) Structurellement, dans le fibrinogène, trois domaines ou régions peuvent être distingués: deux domaines terminaux appelés "domaines D" et un domaine central appelé "domaine E". Le domaine central est lié à chaque côté à un domaine D grâce à un arrangement polypeptide.
Chacun des trois types de chaînes qui composent cette protéine est produit dans le foie à partir de l'expression de trois gènes différents, mais qui sont tous dans le chromosome numéro 4 d'humains.
[TOC]
Fonction de fibrinogène
Hémostase (prévention des pertes de sang)
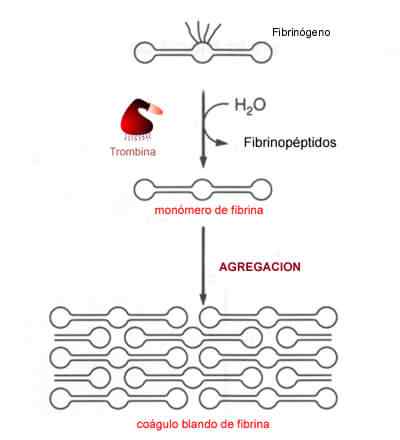
Le fibrinogène est la protéine précurseur d'un polypeptide connu sous le nom de fibrine, qui est l'une des principales composantes des caillots sanguins chez les mammifères, il est donc dit que participe activement au maintien de l'hémostase.
Dans les sites où le corps souffre d'un certain type de plaie ou de blessure, le fibrinogène est coupé par une protéine protéine connue sous le nom de α-tobine. La coupe libère, des extrémités N-terminales des chaînes Aα et Bβ, deux fibrinopeptides appelés fibrinopeptide A et fibrinopeptide B.
Les deux peptides peuvent polymériser spontanément et se croiser pour former un caillot ou une matrice de fibrine transitoire, essentielle pour éviter la perte de sang et pour la réparation normale des tissus, qui se produit à la fin de la cascade de coagulation.
Peut vous servir: adaptation comportementaleCette matrice peut être dégradée par la suite par la plasmine ou d'autres protéases telles que l'élastase, la triptase et certaines catopsines.
Évitez la perte de sang
En plus de la formation de réseaux de fibrine, le fibrinogène peut également éviter que la perte de sang agisse comme une protéine adhésive, favorisant l'agrégation des plaquettes ou servant d'échafaudage initial pour la formation de la formation de caillot.
Réparation de tissus
Les produits de protéolyse de fibrinogène ont également été reconnus comme des promoteurs de la plus haute importance pour la réparation des tissus tels que la vasoconstriction, l'angiogenèse, la migration cellulaire dirigée et la prolifération des cellules telles que les fibroblastes, certaines cellules musculaires lisses et les lymphocytes.
Concentrations de sang élevées (signification)
Lorsque les processus inflammatoires sont déchaînés dans le corps, les cellules hépatiques montrent une augmentation drastique de l'expression et de la synthèse du fibrinogène, ce qui est considéré comme contrôlé par des facteurs tels que l'interleukine-6 (IL-6), certains glucocorticoïdes et oncostatine M.
 Protéine de fibrine formée à partir du fibrinogène
Protéine de fibrine formée à partir du fibrinogène Pour cette raison, des valeurs plasmatiques élevées de cette protéine peuvent indiquer la présence d'infections, de cancers, de troubles inflammatoires, de traumatisme, entre autres.
À l'heure actuelle, il existe des preuves croissantes qui suggèrent que des concentrations élevées de fibrinogène dans le sang peuvent également être associées à une augmentation du risque de troubles cardiovasculaires, notamment: y compris:
- La maladie ischémique du cœur (IHD, de l'anglais Maladie cardiaque ischamique)
- Crises cardiaques et accidents
- Thromboembolie (formation de forme de caillots à l'intérieur d'un vaisseau sanguin)
L'augmentation du fibrinogène plasmatique peut favoriser un état "prothrombotique" ou "hyper coagulé", car il existe une plus grande disponibilité de cette protéine à traiter et contribuer à la production de caillots sans l'existence d'un traumatisme, en plus de cela, il existe un plus grande quantité de protéines qui peuvent être traitées.
Il peut vous servir: flore et faune sinaloa: animaux et plantes plus courantsParmi les facteurs qui influencent l'augmentation de la teneur en fibrinogène plasmatique figurent, en outre, les progrès de l'âge, l'indice de masse corporelle, la dépendance à la cigarette, le diabète et les états post-ménopausiques chez les femmes chez les femmes.
Il est également lié à l'insuline à jeun, au cholestérol de lipoprotéines à basse densité (LDL) et de comptage des leucocytes, mais est inversement lié à la consommation modérée d'alcool, à l'activité physique et à la thérapie de remplacement hormonal.
Faible concentration sanguine (signification)
Une faible concentration ou une faible carence en fibrinogène dans le sang peut se produire en raison de trois conditions pathologiques différentes: afibrinagénémie, hypofibinoginogénémie et dysfibrinoginémie.
Le premier des trois est lié à l'absence totale de fibrinogène dans le plasma et peut signifier une perte mortelle de perte de sang après une plaie, donc cela peut être une condition très dangereuse.
Afibrinogénémie
L'affinagemie peut également avoir une thrombose veineuse et artérielle par l'activation plaquettaire médiée par la thrombine. Chez les femmes, cette pathologie provoque 50% des cas de ménorragie (saignement menstruel abondant) et les femmes enceintes atteints d'afibrinogénémie ont un plus grand risque de présenter des complications obstétricales graves.
Hypofibrinogémie
La pituitoénémie, en revanche, a à voir avec des niveaux anormalement faibles de cette protéine, c'est-à-dire des concentrations entre 0.2 et 0.8 g / l. C'est une condition essentiellement asymptomatique, bien qu'elle puisse également déclencher des saignements abondants.
Les patients atteints de cette condition peuvent souffrir d'une maladie connue sous le nom de maladie de stockage du fibrinogène, qui est due à l'accumulation d'agrégats de fibrinogène dans le réticulum endoplasmique des hépatocytes produisant du fibrinogène.
Dysfibrinoginémie
Enfin, la dysfibrinogénémie est une condition des niveaux normaux de fibrinogène qui ne fonctionnent pas correctement et, au lieu de saignement, a été lié plutôt aux risques de thrombose.
Peut vous servir: rouge de phénol: caractéristiques, préparation, applicationsDe plus, une carence en fibrinogène chronique ou persistante au fil du temps peut être liée à certaines conditions acquises telles que le stade final d'une maladie hépatique ou une malnutrition sévère.
Valeurs de fibrinogène normales
Le fibrinogène, comme déjà mentionné, est synthétisé dans les cellules hépatiques (hépatocytes), sa demi-vie est d'environ 100h et sa concentration normale dans le plasma sanguin, ainsi que d'autres composants circulants, est d'environ 9 micromoles par litre, qui représente environ 1.5 et 4.5 g / L.
Cette concentration dépasse cependant la concentration minimale nécessaire au maintien de l'hémostase, qui se situe entre 0.5 et 1 g / L.
Les références
- Herrick, s., Blanc-brude, ou., Gris, un., & Laurent, G. (1999). Fibrinogène. The International Journal of Biochemistry & Cell Biology, 31 (7), 741-746.
- Kamath, s., & Lèvre, g. ET. H. (2003). Fibrinogène: biochimie, épidémiologie et déterminer. QJM, 96 (10), 711-729.
- Lowe, G. D., Rumley, un., & Mackie, je. J. (2004). Plasma de fibrinogène. Annales de biochimie clinique, 41 (6), 430-440.
- Mosesson, m. W. (2005). Structure et fonctions de fibrinogène et de fibrine. Journal of Thrombose and Haystasis, 3 (8), 1894-1904.
- Mosesson, m. W., Siebenlist, k. R., & Meh, D. POUR. (2001). La structure et les caractéristiques biologiques du fibrinogène et de la fibrine. Annals of the New York Academy of Sciences, 936 (1), 11-30.
- Murray, R. K., Granner, D. K., Mayes, P. POUR., & Rodwell, V. W. (2014). Biochimie illustrée de Harper. McGraw-Hill.
- Doteman-Arbez, M., & Casini, un. (2018). Consquéces cliniques et bases moléculaires de faibles niveaux de fibrinogène. Journal international des sciences moléculaires, 19 (1), 192. Doi: 10.3390 / IJMS19010192
- Pierre, m. C., & Thorp, J. M. (1985). Fibrinogène-un principal facteur de risque coronarien plasma. Jr Coll Gen Pract, 35 (281), 565-569.
- « Caractéristiques de la zone rurale, activités économiques et exemples
- États d'eau solides, liquides et gazeux »

