Facteurs qui affectent la solubilité
- 2072
- 79
- Prof Noah Collet
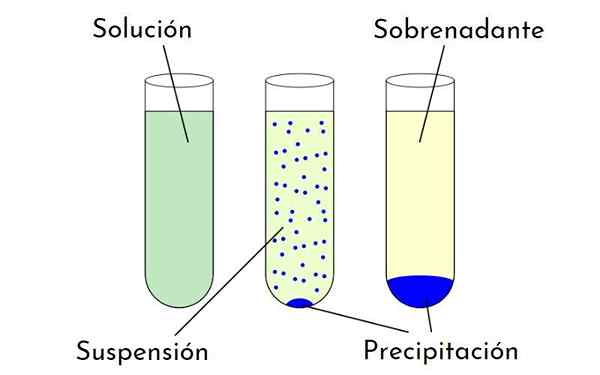
 Diagramme qui montre les différences entre une solution, une suspension et une précipitation qui forme un précipité et un surnageant. Source: Zabmilenko: Orninalzofari: Vectormrmw: Optimisé, Mullang, Wikimedia Commons
Diagramme qui montre les différences entre une solution, une suspension et une précipitation qui forme un précipité et un surnageant. Source: Zabmilenko: Orninalzofari: Vectormrmw: Optimisé, Mullang, Wikimedia Commons Quels sont les facteurs qui affectent la solubilité?
Les principaux facteurs qui affectent la solubilité Ils sont la polarité, l'effet de l'ion commun, de la température, de la pression, de la nature des solutés et des facteurs mécaniques. La solubilité est la capacité d'un produit chimique solide, liquide ou gazeux (appelé soluté) à se dissoudre dans le solvant (généralement un liquide) et à former une solution.
La solubilité d'une substance dépend fondamentalement du solvant utilisé, ainsi que de la température et de la pression. La solubilité d'une substance dans un solvant particulier est mesurée par la concentration de la solution saturée.
Une solution est considérée comme saturée lorsque l'ajout de soluté supplémentaire n'augmente plus la concentration de la solution.
Le degré de solubilité varie considérablement en fonction des substances, de infiniment soluble (complètement miscible), comme l'éthanol dans l'eau, jusqu'à peu soluble, comme du chlorure d'argent dans l'eau. Le terme «insoluble» s'applique souvent aux petits composés solubles.
Certaines substances sont solubles dans toutes les proportions avec un solvant donné, comme l'éthanol dans l'eau. Cette propriété est connue sous le nom miscibilité.
Dans diverses conditions, la solubilité d'équilibre peut être surmontée pour donner une solution appelée sursaturée.
Principaux facteurs qui affectent la solubilité
1. Polarité
Dans la plupart des cas, les solutés se dissolvent dans des solvants qui ont une polarité similaire. Les chimistes utilisent un aphorisme populaire pour décrire cette caractéristique des solutés et des solvants: "Des dissout similaires similaires".
Les solutés non polaires ne se dissolvent pas dans les solvants polaires et vice versa.
2. Effet ion commun
L'effet ionique commun est un terme qui décrit la diminution de la solubilité d'un composé ionique lorsqu'un sel contient un ion qui existe déjà dans l'équilibre chimique est ajouté au mélange.
Cet effet s'explique mieux par le principe de Le Châtelier. Imaginez si le sulfate de calcium composé légèrement soluble, case4, Il est ajouté à l'eau. L'équation ionique nette pour l'équilibre chimique qui en résulte est la suivante:
Cas4 (s) ⇌ca2 + (aq) + SO42− (aq)
Le sulfate de calcium est légèrement soluble. En équilibre, la plupart du calcium et du sulfate existent solidement de sulfate de calcium.
Il peut vous servir: acide iarhydrique (HI): structure, propriétés et utilisationsSupposons le sulfate de cuivre soluble à composé ionique (Cuo4) Il a été ajouté à la solution. Le sulfate de cuivre est soluble. Par conséquent, son seul effet important sur l'équation ionique nette est l'ajout d'ions plus sulfate (donc42-).
Cuso4 (s) ⇌cu2 + (aq) + SO42− (aq)
Les ions de sulfate dissociés de sulfate de cuivre sont déjà présents (commun A) dans le mélange à partir de la légère dissociation du sulfate de calcium.
Par conséquent, cet ajout d'ions sulfate met l'accent sur l'équilibre précédemment établi.
Le principe du catelier dicte que l'effort supplémentaire de ce côté du produit de l'équilibre se traduit par le changement d'équilibre du côté des réactifs pour soulager cette nouvelle tension.
En raison du changement du côté réagissant, la solubilité soluble de sulfate de calcium est encore réduite.
3. Température
La température a un effet direct sur la solubilité. Pour la plupart des solides ioniques, l'augmentation de la température augmente la vitesse à laquelle la solution peut être faite.
À mesure que la température augmente, les particules solides se déplacent plus rapidement, ce qui augmente les possibilités d'interaction avec plus de particules de solvant. Il en résulte une augmentation de la vitesse à laquelle une solution se produit.
La température peut également augmenter la quantité de soluté qui peut être dissoute dans un solvant. En termes généraux, à mesure que la température augmente, plus de particules de soluté se dissolvent.
Par exemple, lorsque du sucre est ajouté à l'eau, c'est une méthode facile pour faire une solution. Lorsque cette solution est chauffée et que le sucre est toujours ajouté, il est constaté que de grandes quantités de sucre peuvent être ajoutées à mesure que la température continue d'augmenter.
La raison pour laquelle cela se produit est qu'à mesure que la température augmente, les forces intermoléculaires peuvent être brisées plus facilement, permettant à plus de particules de soluté d'être attirées par les particules de solvants.
Peut vous servir: Magnésium: histoire, structure, propriétés, réactions, utilisationsIl existe cependant d'autres exemples où l'augmentation de la température a très peu d'effet sur la quantité de soluté qui peut être dissoute.
Le sel de table est un bon exemple: vous pouvez dissoudre presque la même quantité de table de table dans l'eau glacée que vous pouvez dans l'eau bouillante.
Pour tous les gaz, à mesure que la température augmente, la solubilité diminue. La théorie moléculaire cinétique peut être utilisée pour expliquer ce phénomène.
À mesure que la température augmente, les molécules de gaz se déplacent plus rapidement et sont capables d'échapper au liquide. La solubilité à gaz diminue donc.
4. Pression
Le quatrième facteur, la pression, affecte la solubilité d'un gaz dans un liquide, mais jamais d'un solide qui se dissout dans un liquide.
Lorsque la pression est appliquée à un gaz au-dessus de la surface d'un solvant, le gaz se déplacera vers le solvant et occupera certains espaces entre les particules de solvant.
Un bon exemple est le soda gazéifié. La pression est appliquée pour forcer les molécules de co₂ dans le soda. L'inverse est également vrai. Lorsque la pression du gaz diminue, la solubilité de ce gaz diminue également.
Lorsqu'une boisson de boisson à la soude s'ouvre, la pression dans le soda est abaissée, donc le gaz commence immédiatement à sortir de la solution.
Le dioxyde de carbone stocké dans le soda est libéré, et vous pouvez voir une effervescence sur la surface liquide. Si une boîte ouverte de soude est laissée pendant une période de temps, nous pouvons remarquer que la boisson devient plate en raison de la perte de dioxyde de carbone.
Ce facteur de pression de gaz est exprimé dans la loi d'Henry. La loi d'Henry établit qu'à une température donnée, la solubilité d'un gaz dans un liquide est proportionnelle à la pression partielle du gaz sur le liquide.
Peut vous servir: solutions normales: concept, préparation, exemplesUn exemple de la loi d'Henry est produit en plongée. Lorsqu'une personne s'immerge dans des eaux profondes, la pression augmente et plus de gaz se dissolvent dans le sang.
Tout en s'élevant des eaux profondes, le plongeur doit revenir à la surface à une vitesse très lente pour permettre à tous les gaz dissous de quitter le sang très lentement.
Si une personne monte trop rapidement, une urgence médicale peut se produire en raison des gaz qui sortent du sang trop rapidement.
5. Nature du soluté
La nature du soluté et le solvant et la présence d'autres composés chimiques dans la solution affectent la solubilité.
Par exemple, vous pouvez dissoudre une plus grande quantité de sucre dans l'eau, qui sort dans l'eau. Dans ce cas, on dit que le sucre est plus soluble.
L'éthanol dans l'eau est complètement soluble les uns avec les autres. Dans ce cas particulier, le solvant sera le composé qui est en plus grande quantité.
La taille du soluté est également un facteur important. Plus les molécules du soluté sont grandes, plus son poids moléculaire et sa taille sont élevés. Il est plus difficile pour les molécules de solvant d'entourer des molécules plus grandes.
Si tous les facteurs susmentionnés sont exclus, une règle générale peut être constatée que les plus grandes particules sont généralement moins solubles.
Si la pression et la température sont les mêmes qu'entre deux solutés de la même polarité, celle avec des particules plus petites est généralement plus soluble.
6. Facteurs mécaniques
Contrairement à la vitesse de solution, qui dépend principalement de la température, la vitesse de recristallisation dépend de la concentration de soluté à la surface du réseau cristallin, un cas qui est favorisé lorsqu'une solution est immobile.
Par conséquent, l'agitation de la solution évite cette accumulation, maximisant la solution.
Les références
- Solubilité. Récupéré des limites.com.
- Facteurs Affiter la solubilité. Récupéré de CK12.org.
- Éduquer en ligne (s.F.). Facteurs Affiter la solubilité. Récupéré de SoluilityOfThings.com.

