Structure du facteur de nécrose tumorale (TNF), mécanisme d'action, fonction
- 1173
- 223
- Prof Ines Gaillard
Il Facteur de nécrose tumoral (TNF), également connu sous le nom de caquectine, est une protéine produite naturellement dans les cellules phagocytaires ou macrophages du corps humain et d'autres animaux de mammifères. C'est une cytoquine très importante qui participe à la fois aux processus physiologiques normaux et à la diversité des processus pathologiques du corps.
Sa découverte date d'il y a un peu plus de 100 ans, quand w. Coley a utilisé des extraits bactériens bruts pour traiter les tumeurs chez différents patients et a constaté que ces extraits avaient la capacité d'induire la nécrose de ces tumeurs, tout en déclenchant une réaction inflammatoire systémique chez les patients chez les patients.
 Facteur de souris alpha de nécrose tumorale (source: TK Vallery / CC BY-SA (https: // CreativeCommons.Org / licences / by-sa / 3.0) via Wikimedia Commons)
Facteur de souris alpha de nécrose tumorale (source: TK Vallery / CC BY-SA (https: // CreativeCommons.Org / licences / by-sa / 3.0) via Wikimedia Commons) Le principal stimulateur «pro-inflammatoire» activé par les extraits bactériens utilisés par Coley a été identifié en 1975, démontrant qu'un facteur protéique dans le sérum des patients traités a provoqué une lyse tumorale, où le nom qui identifie ce groupe de ce groupe est apparu des protéines (TNF -α).
Environ 10 ans plus tard, en 1984, le gène du "facteur de nécrose tumorale" a été isolé et caractérisé, et à la même date, une autre protéine similaire a été isolée et purifiée dans les lymphocytes T, qui était appelé "lymphotoxine T alpha T" (TLα),,, TLα), qui a ensuite été réputé comme facteur TNF-β.
À l'heure actuelle, de nombreuses protéines similaires au TNF décrit à l'origine ont été définies, qui constituent la famille des protéines TNF (type de facteur de nécrose tumorale) et comprenant des protéines TNF-α, TNF-β, le ligand CD40 (CD40L), le ligand Fas ( Fasl) et bien d'autres.
[TOC]
Structure
Au niveau du gène
Le gène de codage de la protéine TNF-α est trouvé dans le chromosome 6 (chromosome 17 chez les rongeurs) et celui qui code pour la protéine TNF-β précède le précédent dans les deux cas (humain et rongeurs). Ces deux gènes sont en une seule copie et ont une taille approximative de 3 Ko.
Compte tenu du fait que la séquence correspondant à la région de promotion du gène TNF-α a plusieurs sites d'union pour un facteur de transcription connu sous le nom de «facteur nucléaire Kappa B» (NF-κB), de nombreux auteurs considèrent que leur expression dépend de Ce facteur.
La région du promoteur du gène TNF-β, en revanche, a une séquence d'union pour une autre protéine connue sous le nom de "Groupe de mobilité élevé 1" (HMG-1, de l'anglais Groupe de mobilité élevé 1).
Peut vous servir: myosine: caractéristiques, structure, types et fonctionAu niveau des protéines
Deux formes du facteur de nécrose tumorale Alfa ont été décrites, une qui est liée à la membrane (MTNF-α) et une autre qui est toujours soluble (STNF-α). Le facteur de nécrose tumorale bêta, en revanche, n'existe que sous une forme soluble (STNF-β).
Chez l'homme, la forme membranale du TNF-α se compose d'un polypeptide d'un peu plus de 150 déchets d'acides aminés, qui sont attachés à une séquence «leader» de 76 acides aminés supplémentaires. Il a un poids moléculaire apparent d'environ 26 kDa.
La translocation de cette protéine à la membrane se produit pendant sa synthèse et cette forme est "convertie" en forme soluble (17 kDa) par une enzyme connue sous le nom de "l'enzyme de conversion de TNF-α" -α.
Mécanisme d'action
Les protéines appartenant au groupe de facteurs de nécrose tumorale (TNF) exercent leurs fonctions principalement grâce à leur association avec des récepteurs spécifiques dans les cellules du corps humain et d'autres animaux.
Il existe deux types de récepteurs pour les protéines TNF dans les membranes plasmiques de la plupart des cellules du corps, à l'exception des érythrocytes: récepteurs de type I (TNFR-55) et récepteurs de type II (TNFR-75).
Les deux types de récepteurs partagent une homologie structurelle par rapport au site de l'union extracellulaire pour les protéines TNF et se lient également à ceux-ci avec une affinité équivalente. Ils diffèrent donc, dans les routes de signalisation intracellulaires qui s'activent une fois que le processus de liaison du ligand-récepteur s'est produit.
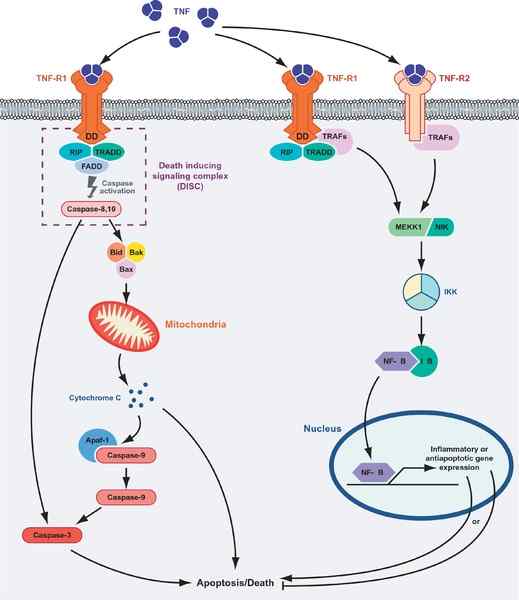 Mort cellulaire ou survie médiée par les protéines TNF. À gauche du graphique, l'itinéraire apoptotique est montré et la route «survie» (source: Masmudur m. Rahman, Grant McFadden / CC par (https: // CreativeCommons.Org / licences / par / 1.0) via Wikimedia Commons)
Mort cellulaire ou survie médiée par les protéines TNF. À gauche du graphique, l'itinéraire apoptotique est montré et la route «survie» (source: Masmudur m. Rahman, Grant McFadden / CC par (https: // CreativeCommons.Org / licences / par / 1.0) via Wikimedia Commons) L'interaction des récepteurs ligands du TNF avec l'un de ses récepteurs favorise l'union de trois récepteurs à un trimère soluble du TNF-α (trimérisation des récepteurs), et cette interaction déclenche des réponses cellulaires même lorsque seulement 10% des récepteurs sont occupé.
Union dans les récepteurs de type I
L'union des récepteurs du ligand avec les récepteurs de type I sert de «plate-forme de recrutement» d'autres protéines de signalisation dans les domaines cytosoliques des récepteurs (la partie interne). Parmi ces protéines, le premier à «obtenir» est la protéine TRADD ou la protéine avec un domaine de mort associé au récepteur TNFR-1 (anglais Protéine du domaine de mort associé à TNFR-1).
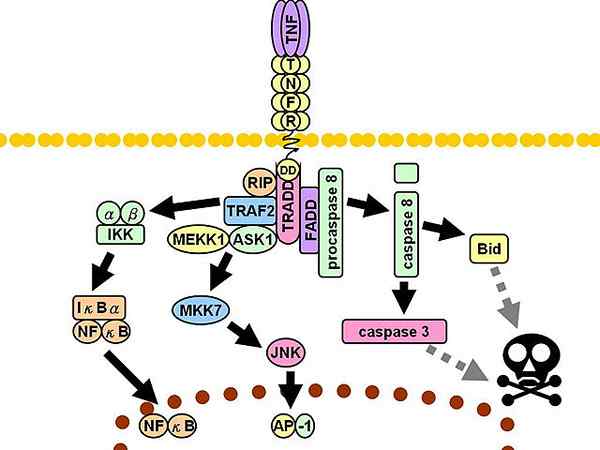 Voie de signalisation TNFR1. Les lignes grises discontinues représentent plusieurs étapes.
Voie de signalisation TNFR1. Les lignes grises discontinues représentent plusieurs étapes. Par la suite, trois médiateurs supplémentaires sont recrutés: protéine d'interaction avec le récepteur 1 (RIP1, de l'anglais Protéine d'interdiction du récepteur 1), Protéine avec domaine de la mort associée aux Fas (Fadd, anglais Protéine du domaine de mort associé au FAS) et le facteur 2 associé au récepteur TNF (TRAF2, anglais Facteur associé aux récepteurs du TNF 2).
Peut vous servir: phénylalanine: caractéristiques, fonctions, biosynthèse, nourritureRécepteurs de type II
Lorsque le TNF se lie aux récepteurs de type II, cela se traduit par le recrutement direct de la protéine Traf2, qui à son tour recrute la protéine Traf1. Ces protéines activent les routes de protéines MAPK (de l'anglais Protéine kinase activée par les mythogènes), très important du point de vue intracellulaire de la signalisation chez les eucaryotes.
De nombreuses voies de signalisation activées après l'union des facteurs de TNF à leurs récepteurs sont également liées à l'activation de facteurs de transcription spécifiques, qui déclenchent des réponses courantes qui ont été décrites comme des «effets» biologiques des protéines TNF.
Fonction
La protéine TNF-α est principalement produite par les macrophages du système immunitaire, tandis que la protéine TNF-β est produite par les lymphocytes T. Cependant, il a été démontré que d'autres cellules du corps produisent également ces facteurs, bien que dans une moindre mesure.
Le facteur de nécrose tumorale a été très étudié pour ses implications dans les processus physiologiques normaux, ainsi que dans les processus pathologiques inflammatoires aigus et chroniques, dans les maladies auto-immunes et dans les processus inflammatoires liés à divers types de cancer.
Ces protéines sont liées à une perte de poids rapide chez les patients souffrant d'infections bactériennes aiguës, qui souffrent d'un cancer et qui passent par un "affrontement" septique ".
Trois activités biologiques différentes ont été décrites pour le facteur de nécrose tumorale:
- cytotoxicité contre les cellules tumorales
- Suppression de la lipoprotéine lipase des adipocytes (LPL) et
- Réduction du potentiel de repos de la membrane des myocytes (cellules musculaires).
La forme membranale TNF-α favorise la cytotoxicité et a été impliquée dans les activités paracrines du TNF dans certains tissus.
Lorsqu'un stimulus en tant qu'endotoxine bactérienne est perçu, cette forme est le TNF protéolypro actif dans le sérum et autres fluides corporels.
Peut vous servir: enzyme: fonctionnement et exemplesParmi ses fonctions biologiques, les protéines TNF peuvent également contribuer à l'activation et à la migration des lymphocytes et des leucocytes, ainsi que la promotion de la prolifération, de la différenciation et de l'apoptose cellulaire.
Inhibiteurs
De nombreux inhibiteurs des protéines TNF de la recette des médecins à des patients atteints de maladies auto-immunes (thérapie anti-TNF). Parmi ces substances, il y a: Infliximab, Etanercept, adalimumab, golimumab et certiolizumab Pegol.
La forme d'utilisation la plus courante est par des injections sous-cutanées dans les cuisses ou l'abdomen, et même la perfusion veineuse directe est pratiquée. Malgré la quantité de ces substances qui peuvent aider certains patients, il existe certains effets négatifs associés à leur utilisation, parmi lesquels une augmentation du risque de contractant les infections telles que la tuberculose ou d'autres infections fongiques.
Inhibiteurs non pharmacologiques "naturels"
Certains fragments «coupés» des protéines TNF (type I et type II) ont également connu sous le nom de protéines Union TNF (TNF-BPS, anglais Tumeur de nécrose facteur de facteur de facteurs de liaison) ont été détectés dans l'urine de patients atteints de cancer, de sida ou de septicémie.
Dans certains cas, ces fragments inhibent ou neutralisent l'activité des protéines TNF, car ils évitent l'interaction du ligand-récepteur.
D'autres inhibiteurs "naturels" des protéines TNF ont été détectés dans certains produits végétaux dérivés du curcuma et de la grenade, bien que des études soient toujours menées à cet égard.
Les références
- Baud, V., & Karin, m. (2001). Transduction du signal par facteur de nécrose tumorale et ses proches. Trends in Cell Biology, 11 (9), 372-377.
- Chu, w. M. (2013). Tumeur de nécrose facteur. Cancer Lotters, 328 (2), 222-225.
- Kalliolias, g. D., & Ivkiv, L. B. (2016). Biologie du TNF, mécanismes pathogènes et stratégies thérapeutiques émergentes. Nature Reviews Rheumatology, 12 (1), 49.
- Lis, k., Kuzawińska, ou., & Bałkowiec -iskra, et. (2014). Inhibiteurs de la tumeur de la nécrose facteur de connaissance. Archives des sciences médicales: AMS, 10 (6), 1175.
- Tracey, MD, K. J., & Cerami, Ph. Donner. (1994). Facteur tumoral de nécrose: une cytokine pléiototrope et une cible thérapeutique. Revue annuelle de la médecine, 45 (1), 491-503.
- Wu, h., & Hymowitz, S. g. (2010). Structure et fonction du facteur de nécrose tumorale (TNF) à la surface cellulaire. Dans Handbook of Cell Signaling (PP. 265-275). Presse universitaire.
- « Structure de phosphate de potassium (K3PO4), propriétés, utilisations
- Quelle est la théorie de l'histoire ou de l'historiologie? »

