Structure Europio, propriétés, obtenez, utilise

- 4190
- 1353
- Jade Duval
Il Europio Il s'agit d'un élément chimique appartenant aux terres rares, représentées par le symbole chimique de l'UE, et dont le nom est dû, évidemment, au continent européen. Il s'agit de la plus réactive des métaux des terres rares, en comparant le lithium, le calcium et le baryum, c'est pourquoi sa diffusion minéralogique est très dispersée.
C'est l'un des métaux les plus rares et les plus chers, en raison de toutes les procédures qui doivent être faites pour extraire sans impuretés. Physiquement, il montre une lueur dorée grisâtre, causée par son oxydation rapide, elle est à peine exposée à l'air. Par conséquent, il est rarement possible de le stocker avec sa couleur argentée authentique.
 Europium oxydé. Source: Images haute résolution des éléments chimiques / CC par (https: // CreativeCommons.Org / licences / par / 3.0)
Europium oxydé. Source: Images haute résolution des éléments chimiques / CC par (https: // CreativeCommons.Org / licences / par / 3.0) L'Europium est si réactif qu'il doit être stocké en ampoules ou en conteneurs scellés dans des atmosphères d'argon inertes. Même immergé dans l'huile minérale est oxydé par le petit oxygène dissous.
Une caractéristique exceptionnelle de l'Europium est sa luminescence, particulièrement observée dans ses composés avec numéro d'oxydation +3, comme les États-Unis2SOIT3, qui est un phosphore rouge appliqué dans les infines de dispositifs électroniques, ainsi que sur les billets en euros pour empêcher sa falsification.
[TOC]
Europio Discovery
La découverte de l'Europium a été créée dans des parties, tout au long du XIXe siècle et dans différents pays (Suède, Allemagne et Suisse) du continent européen. Les ions europium étaient difficiles à identifier parce que leurs spectres d'absorption se mélangeaient à ceux d'autres métaux de terres rares, comme la colline, le gadolinium et le lanthéan, ainsi que le samarium.
Par conséquent, l'identification et l'isolement de tous ces métaux ont traîné l'Europium comme une impureté sans caractériser. Par exemple, l'isolement d'un pur échantillon de Cerio, en 1839 par Carl Gustav Mosander, avait comme produit la reconnaissance d'autres nouveaux éléments: Lantano et Dimio.
Tout en étudiant le Dimio et la conclusion a été conclue qu'elle consistait vraiment en un mélange d'autres éléments (proseodymium et néodyme), le Samario est apparu, trouvé en 1879 par Paul èmile Lecoq.
Peut vous servir: hydrure en aluminium (ALH3): structure, propriétés, utilisationsPlus tard, en 1886, le chimiste suisse Jean Charles Galissard a purifié des échantillons de samarium trouvant du gadolinio. Lecoq pour 1892 avait déjà étudié les spectres de Gadolinio et celui d'un autre nouvel élément.
Quinze ans plus tard, en 1901, le chimiste français Eugène Anatole DeMarcay a finalement isolé ce nouvel élément et l'a baptisé comme Europium, en l'honneur de l'Europe.
Structure chimique de l'Europium
Les atomes d'Europium restent unis grâce à la caution métallique, y participant les électrons de leurs orbitales 4F et 6S. À la suite de ses caractéristiques électroniques, des radios atomiques et du mode de son emballage, l'Europium finit par adopter une structure cristalline cubique centrée sur le corps (BCC), étant l'une des moins denses.
Il n'y a pas de sources bibliographiques qui mentionnent un autre polymorphe pour l'Europio, à part ladite phase BCC, dans d'autres gammes de température; Mais sous différentes pressions.
Par exemple, l'Europium soumis à une pression proche de 18 GPA adopte une structure hexagonale compacte, puis se transforme enfin en une phase monoclinique en pressions plus élevées du 31.5 GPA.
Configuration électronique
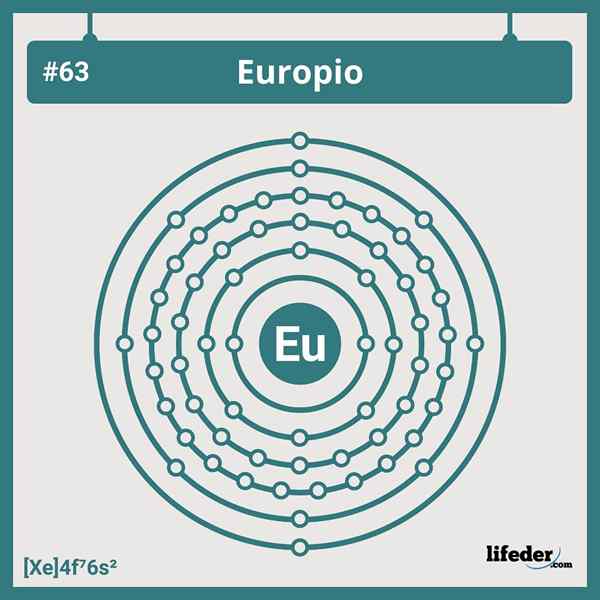 Configuration électronique de l'Europium
Configuration électronique de l'Europium La configuration électronique abrégée de l'Europium est:
[XE] 6S24F7
Étant en position ou le groupe 7 de la série Lantanide, il a sept électrons occupant ses 4F orbitales; Et par conséquent, il ne correspond à aucune des écarts que nous trouvons dans les configurations électroniques pour les éléments du tableau périodique.
Propriétés Europio
Apparence physique
Métal blanc argenté, dureté douce similaire à celle du plomb, et qui devient doré lorsqu'elle est exposée à l'air, couvrant une couche d'oxyde et de carbonate.
Numéro atomique
63
Masse molaire
151.96 g / mol
Point de fusion
826 ºC
Point d'ébullition
1529 ºC
Densité
Solide: 5.264 g / cm3
Au point de fusion: 5.13 g / cm3
États d'oxydation
Les principaux états d'oxydation de l'Europium sont +2 (UE2+) et +3 (UE3+), Étant +1 (UE+) Le moins commun des trois.
Peut vous servir: lien covalent polaire: caractéristiques et exemplesÉnergies d'ionisation
-Premièrement: 547.1 kJ / mol (UE+ gazeux)
-Deuxième: 1085 kJ / mol (UE2+ gazeux)
-Troisième: 2404 kJ / mol (UE3+ gazeux)
Électronégativité
1.2 sur l'échelle Pauling.
Ordre magnétique
Paramagnétique
Réactivité
La réactivité de l'Europium est comparable à celle du lithium et, par conséquent, c'est le métal le plus réactif des terres rares. Par exemple, réagissez rapidement avec de l'eau pour former son hydroxyde correspondant, UE (OH)3, Le jaune, qui contrairement aux hydroxydes alcalins est insoluble dans l'eau:
2 eu + 6 h2O → 2 EU (OH)3 + 3 h2
Aussi, quand il brûle dans un plus léger oxydé aux États-Unis2SOIT3 Et rejeté une flamme rougeâtre, rappelant celle du lithium:
4 eu + 3 o2 → 2 EU2SOIT3
L'Europium est capable de former de nombreux composés avec l'état d'oxydation de +2, car il a ses orbitales F À moitié plein (4F7), ce qui donne à son atome une stabilité électronique inhabituelle.
Le cation européen2+ présente un comportement chimique similaire à celui de BA2+, Mais contrairement à ce dernier, il agit comme un agent réducteur modérément fort, oxydant les États-Unis3+.
Obtention
Matière première
L'Europium est présent dans les minéraux de terres rares telles que la Bastnasita et la monazite. Cependant, parce qu'il maintient une certaine similitude avec les métaux alcalins et alcalines par rapport à leur réactivité, leurs ions sont très dispersés dans le cortex terrestre à côté des minéraux de calcium ou d'autres métaux, il n'y a donc pas de minéral seul qu'il est riche en Europium. C'est pourquoi votre obtention est très chère.
Processus
Les ions européens3+ Ils font partie de nombreux phosphates de rouille et de terres rares. Par conséquent, la première étape consiste à les séparer des autres métaux présents. Pour ce faire, les minéraux sont traités, en particulier le Bastnasite; Ils sont touchés, se dissolvent dans des acides ou des bases forts, et les précipitations fractionnées sont soumises en utilisant divers réactifs. De même, la chromatographie d'échange d'ions est utilisée pour séparer les États-Unis3+.
Au fur et à mesure que le minéral est traité, un concentré d'ions EU est obtenu3+, qui peut être réduit en utilisant du zinc métallique ou un amalgame de celui-ci, afin qu'ils soient réduits aux États-Unis2+. Puis les États-Unis2+ Coprécipita sur le carbonate ou le sulfate de baryum.
Peut vous servir: hydrogénation catalytiqueCe précipité est maintenu et subit une séparation pour obtenir l'oxyde de l'UE2SOIT3, qui est réduit avec Lantano dans un creuset de Tantalio, pour enfin distiller et condens l'Europium métallique.
Une autre méthode pour obtenir l'Europium consiste à effectuer une électrolyse d'un mélange d'EUCL3 et NaCl ou Cacl2 fondu. Ainsi, le chlore gazeux se produit à l'anode, tandis que l'Europio métallique se forme dans la cathode.
Utilisations / applications
 La luminescence rougeâtre observée dans ce billet euro, sous une lampe UV, est due à un composé Europium. Source: repro par h. Grobe / cc by (https: // CreenIvecommons.Org / licences / par / 3.0)
La luminescence rougeâtre observée dans ce billet euro, sous une lampe UV, est due à un composé Europium. Source: repro par h. Grobe / cc by (https: // CreenIvecommons.Org / licences / par / 3.0) L'Europium sous sa forme métallique manque de routine. Cependant, ses composés sont une autre histoire, en particulier son oxyde de l'UE2SOIT3, dont la phosphorescence a été faite par un composant indispensable des écrans sur les appareils, les moniteurs et les téléviseurs. C'est parce qu'il s'agit d'un phosphore rouge, émettant une lumière rouge caractéristique.
La phosphorescence rougeâtre de l'Europio (III) est également utilisée pour empêcher les billets d'euros d'être falsifiés, illuminant avec une lumière UV pour confirmer sa légitimité.
D'un autre côté, lorsqu'il est mélangé avec des composés euro (II), qui sont des allumettes bleuâtres, une lumière blanche est obtenue, très récurrente dans le verre des lampes fluorescentes.
L'Europium est ajouté en petites quantités à l'aluminate de strontium pour préparer des phosphores de différentes couleurs, qui se distinguent pour avoir une phosphorescence à long terme.
Les références
- Fhiver & Atkins. (2008). Chimie inorganique. (quatrième édition). Mc Graw Hill.
- Centre national d'information sur la biotechnologie. (2020). Europium. Résumé des éléments PubChem. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement
- Wikipédia. (2020). Europium. Récupéré de: dans.Wikipédia.org
- Les éditeurs d'Enyclopaedia Britannica. (2020). Europium. Récupéré de: Britannica.com
- R. J. Mari et al. (27 août 2012). Europium-iv:. Récupéré de: Journaux.SPA.org
- David. Skowron. (26 novembre 2017). À quoi sert Europium? - Utilisations communes et historiques. Étude. Récupéré de: étudier.com
- Docteur. Doug Stewart. (2020). Faits d'élément europium. Récupéré de: Chemicool.com
- « Origine du monothéisme, caractéristiques et religions
- Concept des différences culturelles et exemples entre les pays »

