Structure de l'étain, des propriétés, de l'obtention, des utilisations

- 4785
- 475
- Lucas Schneider
Il étain C'est un métal appartenant au bloc p du tableau périodique, dont le symbole chimique est SN, et qui est situé dans le groupe 14, le carbone. En dépit d'être un métal largement utilisé dans toute l'humanité depuis l'Antiquité, la vérité est qu'il s'agit d'un métal rare dans la croûte terrestre (2.3 ppm).
C'est un métal argenté, doux, ductile et malléable. Il a un nombre atomique de 50, et ses états prédominants ou ses nombres d'oxydation sont +2 (Sn2+) et +4 (sn4+), Étant les composés de l'étain (ii), comme le sncl2, Bons agents réducteurs.
 Alotropes en étain. Source: Zinn_9.JPG: De: User: Tomihahndorf.Travail dérivé: MaterialScientist / CC By-S (https: // CreativeCommons.Org / licences / by-sa / 2.0)
Alotropes en étain. Source: Zinn_9.JPG: De: User: Tomihahndorf.Travail dérivé: MaterialScientist / CC By-S (https: // CreativeCommons.Org / licences / by-sa / 2.0) L'étain a comme symbole Sn, qui est une abréviation du mot latin "stannum". L'étain est un métal résistant aux attaques d'eau et à l'air à température ambiante; Mais dans l'air chaud forme du dioxyde d'étain, snam2.
La propriété d'être résistant à la corrosion et d'avoir un faible point de fusion, a servi à avoir de nombreuses applications; comme le revêtement des surfaces métalliques et le soudage.
L'étain a deux formes allotropes principales: la forme β blanche et solide; et les contextes α, gris et normalement poussiéreux (plus cassants). Par conséquent, la forme β est la plus utilisée dans les applications d'étain.
Une autre propriété importante de l'étain est sa capacité à faire partie d'alliages avec plusieurs métaux, le plus ancien étant le bronze, un alliage de cuivre et de boîte.
[TOC]
Découverte
 Granules d'étain. Source: Nephronus, CC0, via Wikimedia Commons
Granules d'étain. Source: Nephronus, CC0, via Wikimedia Commons L'étain est un métal connu depuis les temps anciens. Par conséquent, on ne sait pas qui était son découvreur; Et beaucoup moins, l'année et le lieu de sa découverte.
Le bronze est un alliage de cuivre avec l'étain et l'arsenic. Il est possible que l'élaboration de cet alliage soit une conséquence d'un fait fortuit et involontaire, car les premiers objets en bronze - à l'âge du bronze - ont été formés par du cuivre et de seulement des traces d'arsenic.
Ces objets sont apparus dans le Proche-Orient où l'arsenic est associé au cuivre. Mais depuis le début, la toxicité de l'arsenic a été mise en évidence, réalisant son remplacement2).
Les Grecs anciens ont obtenu l'étain par le commerce maritime et ont qualifié la source de leur boîte de «cassiterdes» qui signifie «îles de l'étain». Il est possible que ces îles soient situées à Cornelles, britanniques ou en Espagne, où il y a de grands dépôts en étain.
Il peut vous servir: subsalicylate de bismuth: structure, propriétés, utilisations, effetsStructure chimique de l'étain
Lorsqu'il y a deux alotropes: l'étain blanc ou le β-SN, et la boîte grise ou α-SN, nous aurons deux structures cristallines. Le β-SN est centré sur le corps (BCT), qui caractérise la malléabilité de la boîte blanche.
Pendant ce temps, la structure de l'α-SN est du diamant; c'est-à-dire que les atomes SN sont liés en formant des filets de tétraèdre, sans l'existence d'une liaison métallique du tout.
L'étain présente également deux autres alotropes dans différentes conditions de pression (dans l'ordre du GPA) et la température (au-dessus de 161 ºC): σ-sn et γ-sn.
Configuration électronique
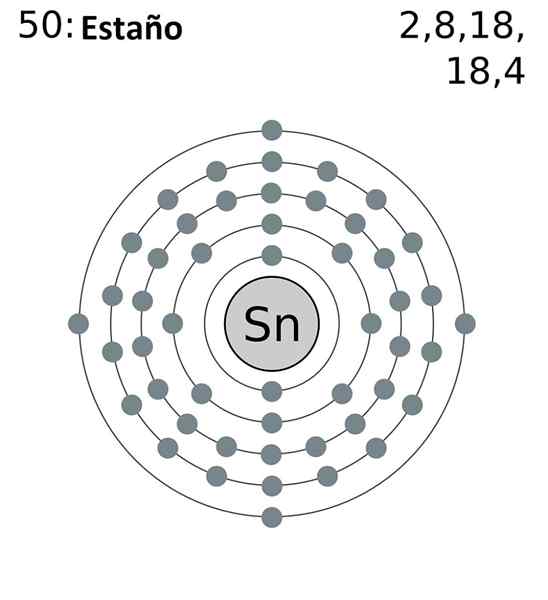
La configuration électronique abrégée en étain est la suivante:
[Kr] 4ddix 5s2 5 P2
Ajout de tous les électrons, nous aurons un total de 14, le même nombre qui correspond à votre groupe. Cependant, seuls les électrons des orbitales 5s et 5p sont ceux qui participent aux réactions chimiques de l'étain, car celles du 4D ne sont pas énergiquement disponibles.
Propriétés de l'étain
Apparence et caractéristiques physiques
L'étain est un métal doux, ductile et malléable, qui peut être froid et tourner. Son faible point de fusion permet d'adhérer aux surfaces nettoyantes de métaux ou d'alliages tels que l'acier, le cuivre et ses alliages, les protégeant de l'oxydation.
Lorsqu'un morceau d'étain est plié, il coupe, émettant un son caractéristique connu sous le nom de «Shout Tin», une conséquence de l'écrasement des cristaux.
Tin a deux formes allotropes: β et α. La forme β correspond à un solide blanc et est responsable des applications d'étain; Tandis que la forme α est une poudre grisâtre.
 Emplacement de l'étain dans le tableau périodique. Source: Image de Daniel Mayer ou Greatpatton et publié en termes du GNU FDL
Emplacement de l'étain dans le tableau périodique. Source: Image de Daniel Mayer ou Greatpatton et publié en termes du GNU FDL La forme β est présentée à des températures supérieures à 13.2 ºC. Lorsque la température baisse 13.2 ºC, les changements d'étain de la forme β à la forme α. Ce phénomène n'est pas souhaitable et est évité en ajoutant d'autres métaux à l'étain, comme l'antimoine ou le bismuth, qui bloquent ce changement et prolongeant sa durée de vie utile.
L'étain est le premier supraconducteur connu à des températures inférieures à 3.72 K.
Numéro atomique
cinquante
Masse molaire
118.71 g / mol
Point de fusion
231.93 ºC
Point d'ébullition
2602 ºC
Densité
Alotropo β: 7.265 g / cm3
Alotropo α: 5.769 g / cm3
États d'oxydation
L'étain a plusieurs états d'oxydation: -4, -3, -2, -1, 0, +1, +2, +3, +4. Cependant, la plupart de leurs composés ont la boîte avec des états d'oxydation +2 (Sn2+) et +4 (sn4+).
Peut vous servir: composés organiquesÉnergies d'ionisation
Premièrement: 708.6 kJ / mol
Deuxième: 1411.8 kJ / mol
Troisième: 2943.0 kJ / mol
Électronégativité
1.96 sur l'échelle Pauling
Réactivité
L'étain est un métal résistant à l'action de l'air et de l'eau à température ambiante, mais lorsqu'il est chauffé dans l'air forme de l'oxyde d'étain (IV), Snam2, qui est faiblement acide. Il est attaqué par les acides et les alcalis, et en présence d'oxygène peut agir dans certains cas comme catalyseur.
Obtention
 Casiterite Mineral est la principale source minéralogique de l'étain. Source: Rob Lavinsky, Irocks.com-cc-by-sa-3.0 / cc by-sa (https: // CreativeCommons.Org / licences / by-sa / 3.0)
Casiterite Mineral est la principale source minéralogique de l'étain. Source: Rob Lavinsky, Irocks.com-cc-by-sa-3.0 / cc by-sa (https: // CreativeCommons.Org / licences / by-sa / 3.0) L'étain, du point de vue de son occurrence, est un métal rare, car il a une abondance dans l'écorce terrestre de seulement 2 ppm. Casiterite Mineral, un minéral d'oxyde d'étain, est la seule source commerciale en étain.
La casitérite est un minéral noirâtre trouvé dans des terrains boueux sur les rives des rivières. L'étain est extrait de la casitérite en réchauffant jusqu'à 1370 ºC avec du charbon ou du coke pour produire sa réduction.
L'étain produit est impur, il est donc traité avec de l'hydroxyde de sodium ou de l'acide chlorhydrique pour solubiliser l'étain. Ensuite, ceci est soumis à l'électrolyse, étant l'anode en étain et la cathode de fer. L'étain est déposé sur la cathode, avec une pureté supérieure à 90%.
Utilisations / applications
Protection contre la corrosion
L'étain est un métal résistant à la corrosion. La boîte ou l'étain de So-appelée est un récipient en acier, recouvert d'une couche d'étain pour éviter l'oxydation.
Les canettes ont été utilisées pour stocker la nourriture et d'autres substances, par exemple: peintures, laques, solvants, etc. Mais ils sont actuellement remplacés par des contenants en aluminium ou en plastique. Les tuyaux et les soupapes recouverts d'étain maintiennent l'eau et boivent la pureté.
Alliages
 Les premières utilisations pour les alliages d'étain ont été de fabriquer des conteneurs ou des ustensiles tels que des canettes et des cruches de ce garde-manger. Source: Voyages de papillons - Serge Ouachee / CC par -sa (https: // CreativeCommons.Org / licences / by-sa / 3.0)
Les premières utilisations pour les alliages d'étain ont été de fabriquer des conteneurs ou des ustensiles tels que des canettes et des cruches de ce garde-manger. Source: Voyages de papillons - Serge Ouachee / CC par -sa (https: // CreativeCommons.Org / licences / by-sa / 3.0) L'homme a commencé à utiliser le bronze pendant plus de 5000 ans. Le bronze est un alliage de cuivre et d'étain utilisé dans l'élaboration des outils, des armes, des ustensiles ménagers.
De la même manière que la peau, un alliage initialement en étain et en plomb, a été utilisé pour fabriquer des pots, des assiettes, etc. Mais en raison de la toxicité du plomb, Peel est actuellement fabriqué avec de l'étain, de l'antimoine et de l'alliage de cobalt.
Il peut vous servir: acide hypoyode (HIO)L'alliage et le plomb en étain ont un point de fusion bas, une propriété qui a permis son utilisation dans le soudage, une technique qui sert à assembler des pièces présentes dans les circuits électriques et électroniques. Il y a des voitures dans lesquelles l'étain est en alliage avec du fer, tandis qu'ils sont utilisés dans les véhicules aérospatiaux en aluminium, en étain et en titane.
Les alliages de circonium, également appelés zircaloys, sont utilisés dans les réacteurs nucléaires et ont une petite quantité de boîte.
 Échantillons d'étain. Source: Ondřej Mangl, domaine public, via Wikimedia Commons
Échantillons d'étain. Source: Ondřej Mangl, domaine public, via Wikimedia Commons L'alliage de l'argent et de l'étain a été utilisé dans les amalgames dentaires.
Un alliage cristallin avec l'élément Niobio est un supraconducteur qui fonctionne à une température de 18 K et maintient sa propriété dans un champ magnétique fort.
Verre
L'étain est utilisé dans la procédure Pilkington pour produire du verre de fenêtre. Le verre fondu est placé sur une surface d'étain fondu, acquérant le verre une surface plate et lisse. Cette technique est toujours utilisée avec succès.
Les sels d'étain sont pulvérisés sur le verre pour obtenir une doublure électrique conductrice, en mesure de utiliser pour fabriquer des panneaux d'éclairage et du pare-brise sans gel.
Composés en étain
Chlorure de péché (sncl2) Il est utilisé dans l'étain galvanisé et comme agent réducteur dans la fabrication de polymères et de colorants. Fluorure d'étain (SNF2) C'est un ingrédient actif dans les pâtes dentaires.
Pendant ce temps, son oxyde est un catalyseur utile dans certains processus industriels. De plus, il est utilisé comme poudre pour polir en acier.
Les composés d'étain organiques sont utilisés comme biocides et fongicides, étant toxiques pour les humains. Des stabilisateurs organiques d'étain sont utilisés pour éviter les changements dans le chlorure de polyvinyle en raison de l'exposition à la lumière et à la chaleur.
Le chlorure Isñico (SNCL4) est utilisé comme stabilisateur de parfum et comme matériau de départ pour d'autres sels d'étain.
Les références
- Fhiver & Atkins. (2008). Chimie inorganique. (quatrième édition). Mc Graw Hill.
- Wikipédia. (2020). Étain. Récupéré de: dans.Wikipédia.org
- Centre national d'information sur la biotechnologie (2020). Étain. PubChem Comunund Résumé pour CID 23974. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement
- Docteur. Doug Stewart. (2020). Faits d'élément d'étain. Récupéré de: Chemicool.com
- Les éditeurs d'Enyclopaedia Britannica. (2020). Étain. Récupéré de: Britannica.com
- Bell, Terence. (26 août 2020). Les propriétés, la production et les applications de l'étain. Récupéré de: Thoughtco.com
- Lentech b.V. (2020). Étain. Récupéré de: lentech.com
- Stéphanie Pupas. (28 juillet 2015). Faits sur l'étain. Récupéré de: LiveScience.com
- Actes de conférence AIP. (9 février 2018). Récupération d'étain à partir de scories en étain à l'aide de la méthode d'électrolyse. est ce que je.org / 10.1063/1.5024070

