Lien pi
- 4321
- 137
- Prof Noah Collet
Nous expliquons quel est le lien PI, comment ses caractéristiques sont formées, et nous donnons plusieurs exemples
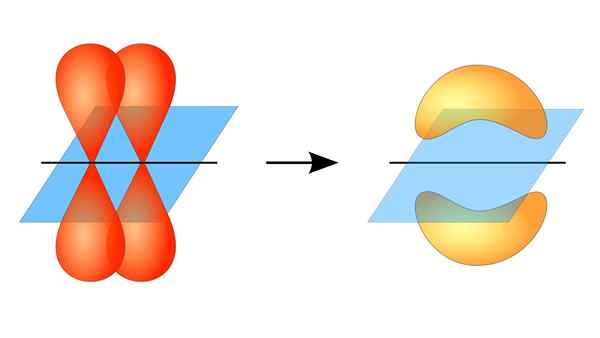
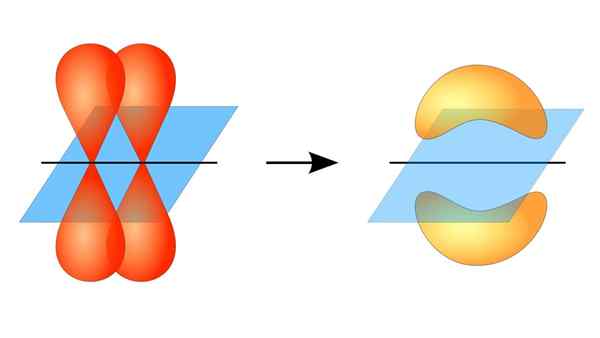 Deux orbitales p formant un lien π
Deux orbitales p formant un lien π Qu'est-ce qu'un lien pi?
UN Lien pi (π) Il s'agit d'un type de lien covalent caractérisé par la prévention du mouvement de rotation libre des atomes et d'origine entre une paire d'orbitales atomiques purs, entre autres particularités. Il existe des liens qui peuvent être formés entre les atomes par leurs électrons, qui leur permettent de construire des structures plus grandes et plus complexes: les molécules.
Ces liens peuvent être de variétés différentes, mais les plus courantes dans ce domaine d'étude sont la covalente. Les liaisons covalentes, également appelées moléculaires, sont un type de lien où les atomes impliqués partagent des paires d'électrons.
Cela peut se produire en raison de la nécessité pour les atomes de rechercher la stabilité, formant ainsi la plupart des composés connus. En ce sens, les liaisons covalentes peuvent être simples, doubles ou triples, selon la configuration de leurs orbitales et la quantité de paires d'électrons partagées entre les atomes impliqués.
C'est pourquoi il existe deux types de liaison covalente qui se forment entre les atomes en fonction de l'orientation de leurs orbitales: les liaisons sigma (σ) et les liaisons Pi (π) (π).
Il est important de différencier les deux liens, car la liaison Sigma est présentée dans des syndicats simples et le Pi dans plusieurs syndicats entre les atomes (deux électrons ou plus sont partagés).
Comment sont les formulaires de liaison PI?
Afin de décrire la formation du lien PI, il devrait d'abord être discuté du processus d'hybridation, car il intervient dans certains liens importants.
L'hybridation est un processus où se forment des orbitales électroniques hybrides; c'est-à-dire où les orbitales et p des sous-niveaux atomiques peuvent être mélangés. Cela provoque la formation d'orbitales SP, SP2 et sp3, qui sont appelés hybrides.
Peut vous servir: réaction réversible: caractéristiques et exemplesEn ce sens, la formation des liens PI se produit grâce au chevauchement de quelques lobes appartenant à une orbitale atomique sur une autre paire de lobes qui sont dans une orbitale qui fait partie d'un autre atome.
Ce chevauchement orbital se produit latéralement, de sorte que la distribution électronique est concentrée principalement au-dessus et en dessous du plan qui forment les noyaux atomiques liés et fait plus faible les liaisons PI que les liaisons sigma.
Lorsque vous parlez de la symétrie orbitale de ce type d'union, il convient de mentionner qu'il est égal à celui du type P de type P tant qu'il est observé via l'axe formé par le lien. De plus, ces syndicats sont principalement constitués par les orbitales p.
Pi Bond Formation dans différentes espèces chimiques
Comme les liaisons PI sont toujours accompagnées d'un ou deux liens supplémentaires (un sigma ou un autre Pi et un Sigma), il est pertinent de savoir que la double liaison qui se forme entre deux atomes de carbone (constituée par une liaison sigma et un pi) possède une énergie de liaison plus faible que celle correspondant à deux fois la liaison sigma entre les deux.
Ceci s'explique par la stabilité de la liaison sigma, qui est supérieure à celle de la liaison PI car le chevauchement des orbitales atomiques dans ce dernier se produit en parallèle dans les régions ci-dessus et sous les lobes, accumulant la distribution électronique de manière plus éloignée de l'atomique noyaux.
Malgré cela, lorsque les liens PI et Sigma sont combinés un lien multiple plus fort que le lien simple en lui-même, qui peut être vérifié en observant les longueurs de liaison entre divers atomes avec des liens simples et multiples.
Peut vous servir: oxydes non métalliquesIl existe des espèces chimiques qui sont étudiées par leur comportement exceptionnel, comme les composés de coordination avec des éléments métalliques, dans lesquels les atomes centraux ne sont unis que par les liaisons PI.
Caractéristiques de liaison PI
Ne permet pas le mouvement de rotation libre des atomes
Les caractéristiques qui distinguent les liaisons PI des autres types d'interactions entre les espèces atomiques sont décrites ci-dessous, en commençant par le fait que cette union ne permet pas le mouvement de rotation libre des atomes, comme le carbone. Pour cette raison, s'il y a une rotation des atomes, la rupture de liaison se produit.
Chevauchement entre les orbitales à travers deux régions parallèles
De même, dans ces liens, le chevauchement entre les orbitales se produit à travers deux régions parallèles, ce qui les rend plus importants que les obligations Sigma et que, pour cette raison, ils sont plus faibles.
Entre quelques orbitales atomiques pures
D'un autre côté, comme mentionné ci-dessus, la liaison PI est toujours générée parmi une paire d'orbitales atomiques pures; Ce moyen est généré parmi des orbitales qui n'ont pas subi de processus d'hybridation, dans lesquels la densité des électrons est principalement concentrée au-dessus et en dessous du plan formé par l'union covalente.
En ce sens, plus d'un lien PI peut être présenté parmi quelques atomes, toujours accompagnés d'une liaison sigma (en double liaison).

De même, vous pouvez donner un triple lien entre deux atomes adjacents, qui est formé par deux liaisons Pi dans des positions qui forment des plans perpendiculaires l'un de l'autre et un lien sigma entre les deux atomes.
Peut vous servir: acide humique: structure, propriétés, obtention, utilisationsExemples de liens PI
Molécule d'éthylène
Comme indiqué précédemment, les molécules constituées par les atomes unis par une ou plusieurs liaisons PI ont toujours plusieurs liens; c'est-à-dire double ou triple.
Un exemple de cela est la molécule d'éthylène (H2C = ch2), qui est constitué par une double union; C'est-à-dire une liaison pi et une liaison sigma entre ses atomes de carbone, en plus des liaisons sigma entre les carbones et les hydrogènes.
Molécule d'acétylène
Pour sa part, la molécule d'acétylène (H-C≡C-H) a un triple lien entre ses atomes de carbone; c'est-à-dire deux liaisons Pi formant des plans perpendiculaires et une liaison Sigma, en plus de ses liaisons hydrogène carbone correspondantes.
Benzène et dérivés
Des liaisons Pi entre les molécules cycliques sont également présentées, comme le benzène (C6H6) et ses dérivés, dont la disposition se traduit par un effet appelé résonance, qui permet à la densité électronique de migrer entre les atomes et la subvention, entre autres, une plus grande stabilité vers le composé.
Dicarbone
Pour illustrer les exceptions mentionnées précédemment, les cas de la molécule dicarbonale (C = C, dans lequel les deux atomes ont une paire d'électrons appariés) et le composé de coordination appelé hexacarbonildihierro (représenté comme foi2(CO)6, qui n'est formé que par des liens PI entre ses atomes).

