Liaison covalente non polaire
- 1700
- 16
- Paul Dumas
Nous expliquons ce qu'est une liaison covalente non polaire, ses caractéristiques et plusieurs exemples
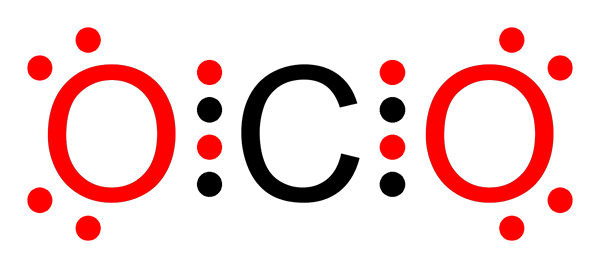
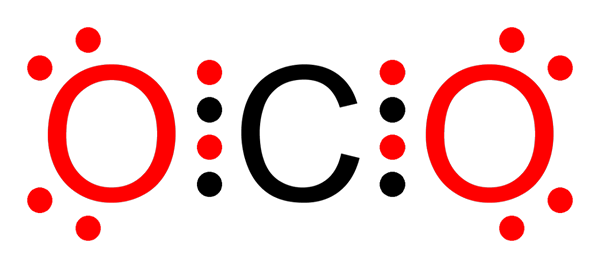 Liaison covalente non polaire de dioxyde de carbone
Liaison covalente non polaire de dioxyde de carbone Qu'est-ce qu'une liaison covalente non polaire?
UN liaison covalente non polaire, Également appelé liaison covalente pure ou apolaire, c'est l'union de deux atomes qui partagent également une ou plusieurs paires d'électrons. Autrement dit.
Ce type de lien se situe entre deux atomes égaux (du même élément) ou entre deux atomes différents, mais qui ont des électronégativités très similaires.
Il existe trois types de liens chimiques qui maintiennent les atomes ensemble. Ce sont: la liaison ionique, la liaison covalente et le lien métallique. Ces liens diffèrent en fonction de la façon dont les électrons sont distribués autour des atomes.
Dans le cas de liaisons covalentes, les deux atomes partagent les électrons de valence, ce qui signifie que ces électrons, au lieu de tourner autour d'un atome, tournent autour des deux. Cependant, ce n'est pas toujours équitable, car les électrons préfèrent passer plus de temps près de l'atome le plus électronégatif, donnant naissance à une liaison covalente polaire.
Dans le cas de liaisons covalentes non polaires, cela ne se produit pas, car les deux atomes ont la même électronégativité ou les électronégativités très similaires.
Caractéristiques du lien covalent non polaire
1. Ils se forment entre les atomes avec des électronégativités égales ou très similaires
Ce sont des liens covalents qui se forment entre des atomes égaux ou qui ont des électronégativités très similaires. En général, une liaison covalente n'est pas considérée comme polaire si la différence d'électrongativités est inférieure ou égale à 0,4.
Peut vous servir: acide succinique: structure, propriétés, obtention, utilisations2. Ils peuvent être simples, doubles ou triples
Selon le nombre de paires d'électrons que les deux atomes partagent, les liaisons covalentes non polaires ou apolaires peuvent être simples, doubles ou triples.
Lorsque la liaison est formée par une seule paire d'électrons, elle s'appelle un lien simple, lorsque deux paires d'électrons sont partagées, elle s'appelle une double liaison, et si trois paires d'électrons sont partagées, elle est appelée triple lien.
3. Ils impliquent presque toujours des non-métaux
Les métaux sont des éléments à très faibles électronégativités qui forment des liens métalliques les uns aux autres. Lorsqu'ils sont liés à des non-métaux, ils forment toujours des liaisons ioniques ou des liens polaires. Pour cette raison, des liaisons covalentes non polaires ne se forment que entre des éléments non métalliques tels que l'hydrogène et le carbone.
4. Ils donnent naissance à des composés apolaires
Un composé qui n'a que des liaisons covalentes non polaires sera formée par des molécules apolaires. Ces types de composés sont caractérisés par des points d'ébullition et de fusion faibles par rapport aux métaux et aux composés ioniques (certains sont même des gaz à température ambiante), ils sont insolubles dans l'eau et sont de mauvais conducteurs de chaleur et d'électricité.
5. Ils peuvent former des composés solides, liquides ou gazeux à température ambiante
Les composés avec des liaisons covalentes non polaires peuvent avoir des points d'ébullition et de fusion faibles mais très variés.
Pour cette raison, certains d'entre eux sont des gaz à température ambiante (comme l'hydrogène, H2, et l'azote, n2), d'autres sont des liquides (comme Bromo, Br2), tandis que d'autres sont solides (comme le naphtalène, cdixH8).
6. Ils ont des énergies de liaison relativement faibles.
Par rapport aux liaisons ioniques, les liaisons covalentes non polaires sont plus faciles à briser, car elles ont une énergie de liaison inférieure. Cela signifie que vous devez utiliser moins d'énergie pour briser une liaison covalente non polaire qu'une liaison ionique.
Peut vous servir: lois stœchiométriquesExemples de liens covalents non polaires
Liaison h-h dans la molécule d'hydrogène (h2)
Dans la molécule d'hydrogène, H2, Deux atomes d'hydrogène partagent leurs seuls électrons de valence pour former une simple liaison covalente.
 Molécule d'hydrogène
Molécule d'hydrogène Comme les deux atomes sont les mêmes, la différence d'électronégativités entre les deux sera nulle, donc ce lien est une liaison covalente non polaire.
Liaison f-f dans la molécule de fluor (f2)
Cet exemple met en évidence le fait qu'il n'a pas d'importance de l'électronégativité d'un atome, mais de la différence d'électronégativités des deux atomes qui forment un lien pour savoir si le lien sera covalent et non polaire ou non.
 Molécule de fluor
Molécule de fluor Le fluor est l'élément le plus électronégatif du tableau périodique, il a donc tendance à éliminer ses électrons des autres éléments pour former des liaisons polaires ou ioniques.
Cependant, lorsqu'un atome de fluorure est lié à un autre égal à lui, ni l'un ni l'autre ne peut éliminer les électrons de l'autre (il n'y a pas de différence d'électronégativité), de sorte qu'ils n'ont d'autre choix que de les partager équitablement et de former, ainsi, ainsi, une forme, un lien covalent non polaire.
O-O liens dans la molécule d'ozone (ou3)
Comme dans le cas de la molécule de fluor, l'oxygène est également un élément très électronégatif. Cependant, en formant des liens avec d'autres atomes d'oxygène, il forme des liaisons covalentes non polaires. C'est le cas de la molécule d'ozone.
 Molécule d'ozone
Molécule d'ozone Dans ce cas, l'atome d'oxygène central est lié à deux autres atomes d'oxygène au moyen de liaisons covalentes non polaires ou apolaires.
Peut vous servir: oxyde de magnésium: structure, propriétés, nomenclature, utilisationsLiaison n-n dans la molécule d'azote (n2)
La molécule d'azote contient une liaison covalente non polaire, dans laquelle chaque atome d'azote partage ses trois électrons de valence disparus avec l'autre.
 Molécule d'azote
Molécule d'azote Pour cette raison, les deux atomes partagent un total de trois paires d'électrons, formant ainsi une triple liaison covalente.
Liens C-H dans la molécule de méthane (ch4)
Le méthane est un exemple de liaison covalente non polaire formée entre les atomes de différents éléments, dans ce cas, le carbone et l'hydrogène.
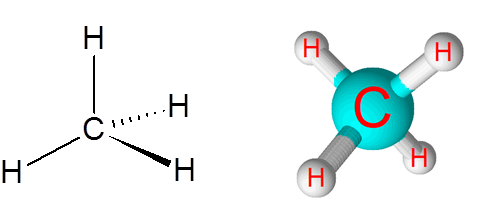 Molécule de méthane
Molécule de méthane La différence d'électronégativité entre les deux éléments est de 0,4, ce qui place cette bordure juste entre les liaisons non polaires et polaires.
Lien c = c dans la molécule d'éthylène (c2H4)
La molécule d'éthylène, également appelée Eteno, a un total de cinq liens. Quatre liens C-H et une double liaison C = C. Dans les deux cas, les liens correspondent à des liaisons covalentes non polaires ou apolaires.
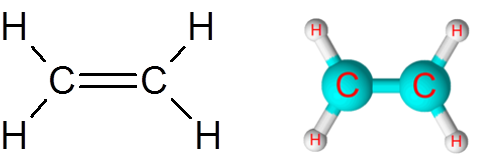 Molécule d'éthylène
Molécule d'éthylène
- « 6 danses et danses typiques de Quintana Roo plus célèbres
- Les 9 danses et danses typiques du Michoacán plus célèbres »

