Une liaison covalente
- 1027
- 91
- Noa Da silva
Qu'est-ce qu'un lien covalent?
La liaison covalente est une interaction forte qui permet à deux atomes ou plus de rejoindre pour former des molécules. C'est l'un des types de liaisons chimiques dans lesquelles quelques électrons participent qui proviennent des orbitales les plus externes des atomes liés.
En théorie, chaque atome contribue l'un des deux électrons lorsqu'il est lié de manière covalente, afin qu'ils gagnent la stabilité. La paire d'électrons, qui devient une sorte de «crochet électronique» entre les deux noyaux atomiques, est partagé également entre deux atomes identiques, mais cela ne se produit pas lorsque les deux atomes sont de deux éléments différents.
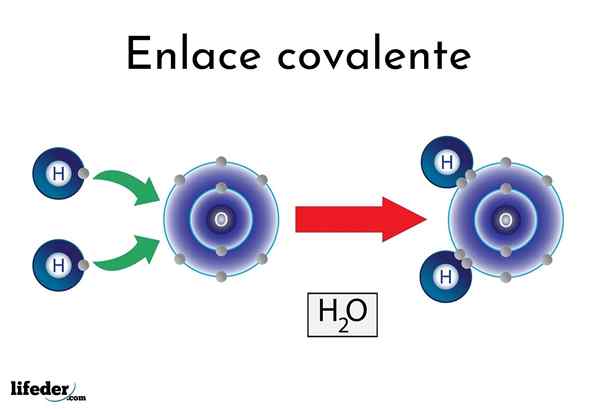
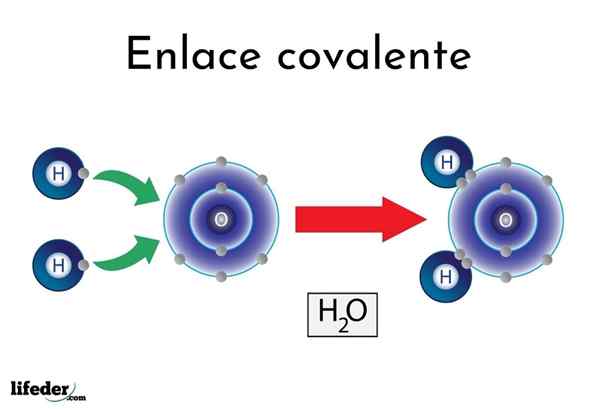 Liaison covalente d'eau
Liaison covalente d'eau Il y a des atomes ou des éléments qui ont une tendance naturelle à produire des électrons, tandis que d'autres préfèrent les gagner.
Par exemple, la célèbre molécule d'eau, H2Ou, il a deux liens covalents: H-O-H. Les hydrogènes et l'oxygène partagent les deux paires d'électrons, mais cette orbite plus proche de l'atome d'oxygène que l'hydrogène. Ce phénomène est dû à la polarité et à l'électronégativité.
Caractéristiques des liaisons covalentes
Les liaisons covalentes présentent les caractéristiques suivantes:
-Ils impliquent quelques électrons pour chaque liaison covalente.
-Ses longueurs sont généralement exprimées en unités PM (picomètres) ou Armstrong (Å).
-Ils sont difficiles à briser, ce qui signifie qu'ils sont très forts.
-Lorsqu'ils se brisent, des changements ou des transformations chimiques se produisent, car la molécule perd des atomes. Dans ce processus, l'énergie est absorbée.
-Quand ils se forment, une nouvelle molécule est née. Dans ce processus, l'énergie est libérée.
Peut vous servir: réactions chimiques: caractéristiques, pièces, types, exemples-Ses longueurs varient selon l'avidité que l'un des atomes liés a vers la paire d'électrons; C'est-à-dire que plus il l'attire, le lien covalent est allongé.
-Les liaisons covalentes les plus simples n'existent que entre deux atomes en même temps et sont représentés avec un script ou une ligne (-).
Il existe d'autres fonctionnalités qui s'appliquent à des liens covalents plus complexes, qui sont cependant également conformes à ce qui est commenté ci-dessus.
Types de liens covalents
Les liaisons covalentes peuvent être classées, en principe, de deux manières: selon le nombre d'électrons partagés, et selon la polarité résultante lorsque la molécule est formée. Les deux seront décrits superficiellement ci-dessous.
Selon le nombre d'électrons partagés
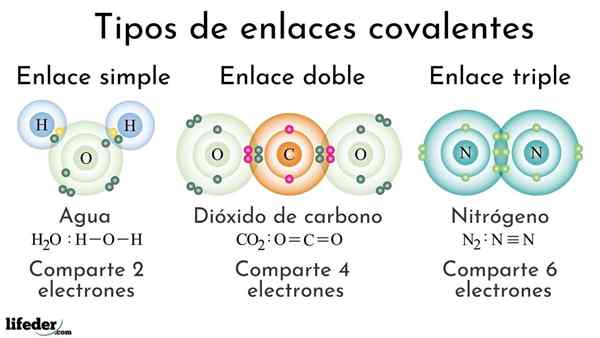 Types de liaisons covalentes en fonction du nombre d'électrons partagés
Types de liaisons covalentes en fonction du nombre d'électrons partagés Les liaisons covalentes en fonction du nombre d'électrons partagés peuvent être classés comme simples, doubles ou triples. Dans l'image supérieure, ces liens respectifs pour trois molécules qui seront discutés ci-dessous sont indiqués.
-
Simple
La simple liaison covalente est celle dans laquelle il n'y a que quelques électrons, c'est-à-dire deux électrons. Un exemple de ce lien que nous voyons dans la molécule d'eau, h2SOIT. Notez que de toutes les liaisons covalentes, le simple, i-i, est le plus long de tous. C'est presque toujours.
-
Double
Dans la liaison double covalente, nous avons, comme son nom l'indique, deux paires d'électrons, ce qui signifie qu'il y a quatre électrons qui renforcent le "crochet électronique" entre les deux atomes liés.
C'est-à-dire qu'une double liaison (=) est plus forte qu'une simple (-). Cependant, il est plus réactif, qui, bien que cela puisse sembler contradictoire, est facile à expliquer en considérant le chevauchement des orbitales atomiques.
Peut vous servir: Polarité (chimie): qu'est-ce que la définition, des exemplesUn exemple de ce lien est observé dans la molécule de dioxyde de carbone, CO2. Les deux atomes d'oxygène restent fortement unis au carbone grâce à cette liaison, ou = c = o, qui, pour être plus forte, plus proche des atomes; Et à son tour, cela conduit à raccourcir le lien.
-
Tripler
Le triple liaison est la plus forte et la plus courte des liaisons covalentes (commune). Notez que pour la molécule d'azote, n2 ou n≡n, leurs atomes représentés par les sphères bleuâtre sont très proches les unes des autres.
Dans le triple lien, nous avons trois paires d'électrons, ce qui est égal à six électrons qui renforcent la liaison covalente entre les deux atomes.
-
Datif
Le lien datif est un type spécial de lien simple qui consiste à la paire d'électrons provient uniquement de l'un des deux atomes liés. Autrement dit, cela pourrait être considéré comme un "partage forcé".
Par exemple, la molécule M2Ou utilisez l'une des paires sans oxygène pour les donner à un ion h+ (H2O: → H+ = [H2OH]+ ou h3SOIT+).
Selon la polarité
Les liaisons covalentes en fonction de la polarité peuvent être classées comme covalentes polaires ou covalentes non polaires.
-
Liaisons covalentes polaires
Il se produit entre deux atomes différents dont la différence d'électronégativité est grande. Il en résulte la formation d'un dipôle, où un atome se concentre négativement (attire les électrons), tandis que les autres se concentrent positivement (donne des électrons). Par exemple, la liaison covalente HF (H-F) est polaire, car le fluorure est plus électronégatif que l'hydrogène.
-
Liens covalents non polaires
Il se produit entre deux atomes identiques dont la différence d'électronégativité est nulle ou très petite. Les molécules mentionnées ci-dessus: je2, SOIT2 et n2 Ils présentent des liaisons covalentes non polaires. Par conséquent, les électrons sont autour des deux atomes avec la même fréquence.
Il peut vous servir: uréthane: structure, propriétés, obtention, utilisationsExemples de liens covalents
Enfin, d'autres obligations covalentes seront répertoriées en plus de celles déjà expliquées, indiquant également leurs types:
H2S (H-S-H), simple covalent polaire | HCL (H-CL), lien covalent simple polaire |
H2 (H-H), pas covalent simple polaire | C2H4 (H-C≡C-H), avec deux liaisons polaires simples (C-H) et un triple lien non polaire (C≡C) |
F2 (F-F), covalent simple non polaire | P2 (P≡P), liaison covalente non polaire (ou apolaire) |
Co₂ (o = c = o), double polaire covalent | S2 (s = s), liaison double covalente non polaire |
HCN (H-C≡N), avec une simple liaison covalente polaire (H-C) et une autre liaison polaire triple (C≡N) | NH3 (N-H), avec trois liaisons covalentes polaires simples |
Les exemples cités correspondent à de petites molécules. Mais les liaisons covalentes sont présentes dans toutes les molécules existantes, y compris les polymères, les biomolécules, les macromolécules, les minéraux, la céramique, les hydrocarbures, entre autres.
Les références
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning.
- Fhiver & Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- María Estela Raffino. (28 juin 2020). Une liaison covalente. Concept.de. Récupéré de: concept.de
- Wikipédia. (2020). Une liaison covalente. Récupéré de: dans.Wikipédia.org
- Camy Fung et Nima Mirzaee. (15 août 2020). Des liaisons covalentes. CHIMISTER BOOLISTexts. Récupéré de: Chem.Bibliothèque.org
- Helmestine, Anne Marie, Ph.D. (27 août 2020). Qu'est-ce qu'une liaison covalente en chimie? Récupéré de: Thoughtco.com

