Structure du dioxyde de chlore (CLO2), utilisation, obtention, risques, propriétés

- 4339
- 947
- Anaïs Julien
Il dioxyde de chlore C'est un composé inorganique formé par l'élément de chlore (CL) et l'oxygène (O). Sa formule chimique est CLO2. C'est un gaz jaune verdâtre à rougeâtre. On ne trouve pas naturellement dans l'environnement.
Il est extrêmement réactif, il est donc courant qu'il soit préparé à l'endroit où il sera utilisé. L'une de ses utilisations les plus importantes est la microbicide, l'antiseptique et la désodorisation car elle élimine les bactéries, les virus et les champignons très facilement et en très faibles concentrations.
 Certains aliments vendus dans les supermarchés peuvent avoir été désinfectés avec du dioxyde de chlore CLO2. Auteur: ElasticComputeFarm. Source: Pixabay.
Certains aliments vendus dans les supermarchés peuvent avoir été désinfectés avec du dioxyde de chlore CLO2. Auteur: ElasticComputeFarm. Source: Pixabay. Il permet de désinfecter les aliments tels que les légumes, les fruits, les viandes, les oiseaux et les fruits de mer. Il sert à hygiéniser les surfaces, les planchers, les salles de bains, les systèmes de ventilation, les piscines, l'équipement de laboratoire, l'équipement de dentiste, etc.
Par conséquent, il est utilisé dans la transformation des aliments, dans les hôpitaux et les cliniques, dans les industries et les magasins. Il est utilisé pour purifier l'eau utilisée pour boire et également les eaux usées municipales.
Il est très efficace en tant qu'agent oxydant, il est donc utilisé pour blanchir la pulpe de papier, les huiles, la farine, le cuir, les fibres textiles, entre autres.
Quand il est sous forme de gaz, il est très dangereux, car il est très explosif et est principalement utilisé dans les solutions aqueuses. Il est toxique s'il est inspiré.
[TOC]
Structure
Le dioxyde de chlore est formé par l'union d'un atome de chlore (CL) avec deux atomes d'oxygène (O). Les liaisons de chlore à chaque oxygène sont covalentes et doubles. Le chlore dans ce composé a une valence de +4.
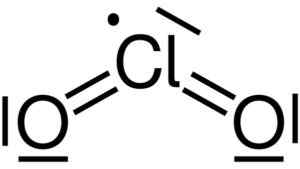 Structure Lewis du dioxyde de chlore2. Yikrazuul [domaine public]. Source: Wikimedia Commons.
Structure Lewis du dioxyde de chlore2. Yikrazuul [domaine public]. Source: Wikimedia Commons. Il a une structure symétrique et en forme d'angle, car il a des électrons libres. C'est-à-dire qu'ils ne forment pas de lien avec aucun autre atome.
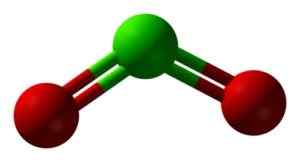 Structure CLO2 en trois dimensions. Vert = chlore; Rouge = oxygène. Ben Mills et Jynto [domaine public]. Source: Wikimedia Commons.
Structure CLO2 en trois dimensions. Vert = chlore; Rouge = oxygène. Ben Mills et Jynto [domaine public]. Source: Wikimedia Commons. Nomenclature
- Dioxyde de chlore
- Oxyde de chlore (IV)
Propriétés
État physique
Greenâtre à gaz jaune rougeâtre.
Poids moléculaire
67,45 g / mol.
Point de fusion
-59 ºC.
Point d'ébullition
11 ºC.
Densité
Liquide à 0 ° C = 1 642 g / cm3
Gaz = 2,33 (densité relative de l'air, air = 1).
Il peut vous servir: alcool isoamyl: structure, propriétés, utilisations et risquesSolubilité
Water Soluble: 2000 cm3 du clochard2 gaz à 100 cm3 d'eau froide ou 0,8 g / 100 ml d'eau à 20 ° C. Soluble dans la solution alcaline et dans la solution d'acide sulfurique h2Swin4.
Propriétés chimiques
Le CLO2 Il est extrêmement réactif et peut exploiter violemment. C'est un agent oxydant très efficace.
Le CLO2 Il se brise violemment s'il entre en contact avec les matières organiques. Si vous êtes dans l'air à une concentration supérieure à 10%, il peut exploser en raison de la lumière du soleil ou de la chaleur.
Vous pouvez également faire exploser en présence de mercure (Hg) ou de monoxyde de carbone (CO).
Sous l'action de l'ultraviolet (UV) ou de l'ozone le CLO2 Il devient du chlore hexoxyde2SOIT6, Composé très instable.
Propriétés de vos solutions aqueuses
Ses solutions aqueuses sont jaunes jaunes ou rougeâtres. Ils sont stables s'ils restent froids, bien scellés et protégés de la lumière du soleil. En présence de lumière, ces solutions sont lentement décomposées pour donner de l'acide chlorhydrique HCL et de l'acide chlorique HCL3.
 Solution d'eau de CLO2 où il est observé qu'un gaz jaune est libéré qui est le CLO2. Auteur: MaterialScientist. Source: Wikimedia Commons.
Solution d'eau de CLO2 où il est observé qu'un gaz jaune est libéré qui est le CLO2. Auteur: MaterialScientist. Source: Wikimedia Commons. Dans les solutions alcalines, le CLO2 Il est décomposé en ions chlorite cloche2- et Clorate3-. Dans les solutions acides, le chloro acide forme hclo2 Et puis cela est décomposé en acide chlorhydrique HCL et en acide chlorique HCLO3.
Autres propriétés
Les vapeurs concentrées de CLO2 Ils sont potentiellement explosifs, il n'a donc pas été possible de se comprimer ni seulement mélangé avec d'autres gaz. Pour cette raison, il est préféré le préparer sur le site où il sera utilisé.
Quand il est très basse des températures dans sa forme hydratée, qui est la façon dont il est parfois transféré, il est solide sous la forme d'un bloc de type glace et d'orange.
Il a une odeur similaire au chlore. Est toxique par inhalation.
Obtention
Peut être obtenu de plusieurs manières. Par exemple, dans certains cas, les solutions CLO2 Ils se préparent à passer un mélange de chlore gazeux (CL2) et l'air (ou chlore et azote gazeux2) à travers une colonne qui contient des granules de chlorite de sodium (naclo2).
Peut vous servir: couche de valence2 naclo2 + CL2 → 2 NaCl + 2 CLO2
Le produit généré contient environ 90% de CLO2, Entre autres composés de chlore.
Il est également obtenu à partir du chlorate de potassium (KCLO3) et l'acide sulfurique (H2Swin4) En présence d'acide oxalique comme réducteur. Dans ce cas, le dioxyde de carbone est également formé (CO2) qui sert à diluer le CLO2.
Il peut être préparé sur le site d'utilisation à base de chlorate de sodium (Naclo3), acide sulfurique (h2Swin4) et le méthanol (choisissez3OH).
Dans l'industrie, il est obtenu par le chlorate de sodium (Naclo3) et le dioxyde de soufre (donc2) En présence d'acide sulfurique.
2 naclo3 + Swin2 + H2Swin4 → 2 CLO2 + 2 NAHSO4
Utilise comme désinfectant
Il peut être utilisé comme un puissant agent antimicrobien. Il a été constaté qu'il est très efficace contre plusieurs micro-organismes, tels que Escherichia coli et le Staphylococcus aureus.
Avec ce dernier, une concentration de seulement 5 ppm de CLO2 Pour en éliminer 100%. C'est bactéricide, antiseptique et désodorisant. Il est efficace sur un large intervalle de pH.
Dans la nourriture
Il est utilisé comme agent antimicrobien dans l'eau pour fumiger les fruits et légumes, dans la transformation des oiseaux des oiseaux, des viandes rouges, de la viande et des organes et des produits marins et des fruits de mer.
 La viande rouge des supermarchés peut avoir été traitée avec du dioxyde de chlore pour les désinfecter. Auteur: Karamo. Source: Pixabay.
La viande rouge des supermarchés peut avoir été traitée avec du dioxyde de chlore pour les désinfecter. Auteur: Karamo. Source: Pixabay. Les solutions de dioxyde de chlore doivent être utilisées dans une concentration qui ne dépasse pas 3 ppm (parties par million) de CLO2 résiduel, de sorte qu'il n'a pas d'effet sur la nourriture.
Après traitement avec CLO2 Tous les aliments doivent être complètement gouvernés avec de l'eau potable, ou doivent être utilisés comme échaudé, cuisinant ou en conserve.
Dans le cas des produits marins, la solution d'égout2 Il doit être utilisé dans l'eau et la glace qui sont utilisées dans le rinçage, le lavage, le dégivrage, le transport ou le stockage. Les fruits de mer crus doivent ensuite être très bien lavés avec de l'eau potable avant la consommation.
 L'eau froide et la glace avec lesquelles les fruits de mer contiennent de petites quantités de CLO2. Auteur: DomainPartures publiques. Source: Pixabay.
L'eau froide et la glace avec lesquelles les fruits de mer contiennent de petites quantités de CLO2. Auteur: DomainPartures publiques. Source: Pixabay. Sur papier et carton qui entrera en contact avec la nourriture
Solutions CLO2 Ils sont utilisés pour éliminer les micro-organismes qui provoquent des minces (comme les algues, les bactéries et les champignons) dans le processus d'eau utilisée dans la fabrication de papier et de carton qui entrera en contact avec les aliments.
Peut vous servir: molécules apolairesDans l'eau potable
Il sert à purifier l'eau et à le rendre buvable (en sécurité à boire). Il est utilisé dans le prétraitement de l'eau qui sera ensuite mis en bouteille pour boire ou l'eau qui sera utilisé comme ingrédient dans la fabrication de boissons ou de boissons gazeuses.
 Certaines boissons gazeuses transformées peuvent contenir de l'eau traitée avec du CLO2. Susan Slater [CC BY-SA (https: // CreativeCommons.Org / licences / by-sa / 4.0)]. Source: Wikimedia Commons.
Certaines boissons gazeuses transformées peuvent contenir de l'eau traitée avec du CLO2. Susan Slater [CC BY-SA (https: // CreativeCommons.Org / licences / by-sa / 4.0)]. Source: Wikimedia Commons. En dentisterie
Il est utilisé dans les instruments utilisés par le dentiste ou le dentiste pour les désinfecter et détruire les organismes pathogènes en eux.
Dans les applications médicales
Les solutions aqueuses de CLO2 Ils ont été utilisés pour traiter la candidose orale (infection buccale). La candidose est une infection par champignon Candida albicans.
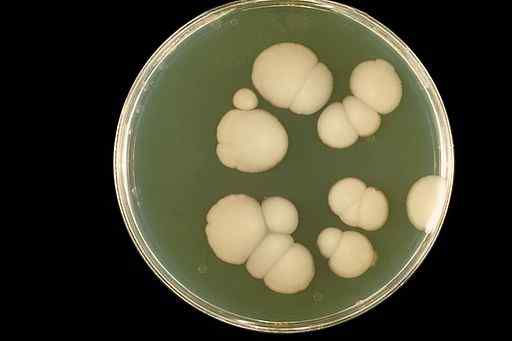 Candida Albicans Fungus Apparence dans une culture de laboratoire. CDC / DR. William Kaplan [domaine public]. Source: Wikimedia Commons.
Candida Albicans Fungus Apparence dans une culture de laboratoire. CDC / DR. William Kaplan [domaine public]. Source: Wikimedia Commons. Le dioxyde de chlore élimine la bouche de la bouche et améliore considérablement l'apparition des tissus oraux sans effets secondaires.
Certains chercheurs médicaux indiquent que les solutions CLO2 Appliqués aux blessures en opération chirurgicale, ils peuvent diminuer ou supprimer la formation des accessions sans affecter la même manière, avec l'avantage supplémentaire de ses propriétés antiseptiques.
Autres utilisations
Pour ses propriétés oxydant et microbicide, le CLO2 est utilisé pour:
- Blanchir la cellulose du bois dans la fabrication de pulpe et de papier, offrant un éclat stable.
- Décorez les graisses et les huiles, le cuir, la farine blanche et les textiles.
- Applications agricoles telles que la désinfection des surfaces dures, l'équipement, les systèmes d'eau et les serres de champignons.
- Applications dans les industries, les magasins et les hôpitaux tels que la désinfection des surfaces dures (murs, planchers, salles de bains), systèmes de ventilation, équipement de laboratoire.
- Désinfecter les appartements et les salles de bains des ménages, les systèmes de climatisation, les systèmes de circulation de l'eau de natation.
- Le traitement des eaux usées municipales et industrielles.
- Nettoyage de la pollution des champs de pétrole.
- Fabrication de sels de chlorure (CL-).
Des risques
- Les vapeurs concentrées de CLO2 Ils sont potentiellement explosifs.
- Il est toxique par inhalation et ingestion. Il est irritant les yeux, le nez et la gorge, peut provoquer un œdème pulmonaire et une bronchite chronique.
- Selon les sources ont consulté le CLO2 ne provoque pas de mutations d'ADN ni ne provoque le cancer chez l'homme.
Les références
- OU.S. Bibliothèque nationale de médecine. (2019). Dioxyde de chlore. Récupéré de pubchem.NCBI.NLM.NIH.Gouvernement.
- Dean, J.POUR. (éditeur). (1973). Le manuel de chimie de Lange (onzième édition). McGraw-Hill Book Company.
- Encyclopédie de la chimie industrielle d'Ullmann. (1990). CINQUIÈME ÉDITION. VCH VERLAGSGELLSCHAFT MBH.
- Coton, F. Albert et Wilkinson, Geoffrey. (1980). Chimie inorganique avancée. Quatrième édition. John Wiley & Sons.
- Bajpai, p. (2012). Jolie de dioxyde de chlore. Effet du blanchiment de dioxyde de chlore sur la qualité de la pulpe. Dans les approches respectueuses de l'environnement pour le blanchiment de la pulpe (deuxième édition). Récupéré de ScienceDirect.com.
- Moran, s. (2018). Chimie de l'eau. Dioxyde de chlore. Dans un guide appliqué sur la conception de l'usine de traitement de l'eau et des effluents. Récupéré de ScienceDirect.com.
- McKen, L. (2012). Introduction à la rédition alimentaire et à la stérilisation médicale. Gasoous chorine diexide. Dans l'effet de la stérilisation sur les plastiques et les élastomères (troisième édition). Récupéré de ScienceDirect.com.
- « Caractéristiques du Paléolithique supérieur, art, organisation sociale
- Structure d'acide sulfonique, nomenclature, propriétés, utilisations »

