Structure de dioxyde de soufre (SO2), propriétés, utilisations, risques

- 5075
- 1384
- Raphaël Meyer
Il dioxyde de soufre C'est un composé inorganique gazeux formé par le (s) et l'oxygène (O), étant sa formule chimique2. C'est un gaz incolore avec une odeur irritante et suffocante. De plus, ce sont des solutions d'acide solubles dans l'eau. Les volcans l'expulsent vers l'atmosphère pendant les éruptions.
Il fait partie du cycle biologique et géochimique du soufre, mais est produit en grande quantité par certaines activités humaines telles que le raffinage de l'huile et des combustibles fossiles brûlant (charbon ou diesel par exemple).
 Dioxyde de soufre2 est publié par des volcans pendant les éruptions. Brocken Inaglory [cc by-s (https: // CreativeCommons.Org / licences / by-sa / 3.0)]. Source: Wikimedia Commons.
Dioxyde de soufre2 est publié par des volcans pendant les éruptions. Brocken Inaglory [cc by-s (https: // CreativeCommons.Org / licences / by-sa / 3.0)]. Source: Wikimedia Commons. So2 C'est un agent réducteur qui permet à Paper Pulp de rester blanc après le blanchiment d'argent avec d'autres composés. Il sert également à éliminer les restes de chlore dans l'eau qui a été traitée avec ce chimiste.
Il est utilisé pour garder certains types de nourriture, pour désinfecter les contenants où la fermentation du jus de raisin se produit pour produire du vin ou de l'orge pour faire de la bière.
Il est également utilisé comme fongicide dans l'agriculture, pour obtenir de l'acide sulfurique, comme solvant et comme intermédiaire dans les réactions chimiques.
So2 Présente dans l'atmosphère est nocive pour de nombreuses plantes, dans l'eau que le poisson affecte et est également l'un des responsables des "pluies acides" qui corrodent les matériaux créés par l'être humain.
[TOC]
Structure
La molécule de dioxyde de soufre est symétrique et forme un angle. L'angle est parce que le SO2 Il a quelques électrons solitaires, c'est-à-dire des électrons qui forment un lien avec n'importe quel atome mais sont gratuits.
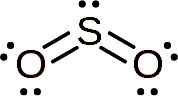 Structure Lewis du dioxyde de soufre où sa forme angulaire et la paire d'électrons libres sont observées. Whittlemario [cc by-sa (https: // CreativeCommons.Org / licences / by-sa / 4.0)]. Source: Wikimedia Commons.
Structure Lewis du dioxyde de soufre où sa forme angulaire et la paire d'électrons libres sont observées. Whittlemario [cc by-sa (https: // CreativeCommons.Org / licences / by-sa / 4.0)]. Source: Wikimedia Commons. Nomenclature
- Dioxyde de soufre
- Anhydrure de soufre
- Oxyde sulfureux.
Propriétés
État physique
Gaz incolore.
Poids moléculaire
64,07 g / mol
Point de fusion
-75,5 ºC
Point d'ébullition
-10,05 ºC
Densité
Gaz: 2,26 à 0 ° C (par rapport à l'air, c'est-à-dire la densité de l'air = 1). Cela signifie qu'il est plus lourd que l'air.
Liquide: 1,4 A -10 ° C (par rapport à l'eau, c'est-à-dire de la densité d'eau = 1).
Solubilité
Soluble dans l'eau: 17,7% à 0 ° C; 11,9% à 15 ° C; 8,5% à 25 ° C; 6,4% à 35 ° C.
Soluble dans l'éthanol, l'éther dietyl, l'acétone et le chloroforme. Il est moins soluble dans les solvants non polaires.
pH
Les solutions aqueuses SOS2 Ils sont acides.
Propriétés chimiques
So2 C'est un puissant agent réducteur et oxydant. En présence d'air et un catalyseur oxyde ainsi3.
Swin2 + SOIT2 → Donc3
Les paires d'électrons solitaires le font parfois se comporter comme une base de Lewis, en d'autres termes, il peut réagir avec des composés où il y a un atome qui manque des électrons.
Il peut vous servir: Fer Ferm: Propriétés, comment elles sont fabriquées, toxicité, utilisationLe cas échéant2 Il est sous forme de gaz et de séche. Cependant, s'il est dans un état liquide ou humide, il produit de la corrosion à ces métaux.
So2 Le liquide avec 0,2% d'eau ou plus produit une forte corrosion en fer, en laiton et en cuivre. C'est corrosif pour l'aluminium.
Quand il est liquide, vous pouvez également attaquer des plastiques, du caoutchouc et des revêtements.
SOS aqueux de SO2
So2 C'est très soluble dans l'eau. Il a été considéré pendant longtemps que dans l'eau de soufre, la forme h2Swin3, Mais l'existence de cet acide n'a pas été démontrée.
Dans So Solutions2 Dans l'eau, les soldes suivants se produisent:
Swin2 + H2Ou ⇔ donc2.H2SOIT
Swin2.H2Ou ⇔ hso3- + H3SOIT+
HSO3- + H2Ou ⇔ donc32- + H3SOIT+
Où HSO3- C'est l'ion bisulfite et le so32- C'est l'ion sulfite. Le sulfit ion donc32- Il se produit principalement lorsqu'un alcali est ajouté à la solution SO2.
Les solutions aqueuses SOS2 Ils ont une réduction des propriétés, surtout si elles sont alcalines.
Autres propriétés
- Il est extrêmement stable par rapport à la chaleur, même jusqu'à 2000 ° C.
- Ce n'est pas inflammable.
Obtention
So2 Il est obtenu par combustion de soufre dans l'air, bien que de petites quantités de forme ainsi se forment également3.
S + O2 → Donc2
Il peut également être produit par chauffage dans l'air de divers sulfures, brûlant des minéraux et minéraux de pyrite contenant des sulfures, entre autres.
Dans le cas de la pyrite de fer, lorsqu'il est oxydé l'oxyde de fer (III) et les SO sont obtenus2:
4 Fes2 + 11 o2 → foi 22SOIT3 + 8 Alors2↑
Présence dans la nature
So2 Il est libéré dans l'atmosphère par l'activité des volcans (9%) mais provient également d'autres activités naturelles (15%) et par des actions humaines (76%).
Les éruptions volcaniques explosives provoquent des fluctuations ou des variations annuelles importantes2 dans l'atmosphère. On estime que 25% du SO2 Émis par les volcans est lavé par la pluie avant d'atteindre la stratosphère.
Les sources naturelles sont les plus abondantes et sont dues au cycle biologique du soufre.
Dans les zones urbaines et industrielles, les sources humaines prédominent. La principale activité humaine qui le produit est la combustion de combustibles fossiles, comme le charbon, l'essence et le diesel. Les autres sources humaines sont les raffineries de pétrole, les usines chimiques et la production de gaz.
 Les activités humaines telles que la combustion du charbon pour l'électricité sont à l'origine de la pollution avec ainsi2. ADREM68 [CC BY-SA (https: // CreativeCommons.Org / licences / by-sa / 4.0)]. Source: Wikimedia Commons.
Les activités humaines telles que la combustion du charbon pour l'électricité sont à l'origine de la pollution avec ainsi2. ADREM68 [CC BY-SA (https: // CreativeCommons.Org / licences / by-sa / 4.0)]. Source: Wikimedia Commons. Chez les mammifères, il est généré de manière endogène, c'est-à-dire dans le corps des animaux et des humains en raison du métabolisme des acides aminés contenant du soufre, en particulier la l-cystéine.
Peut vous servir: éléments liquides: quels sont et des exemplesApplications
Dans la production d'acide sulfurique
L'une des applications les plus importantes du SO2 C'est l'obtention de l'acide sulfurique H2Swin4.
2 Alors2 + 2 h2Ou + o2 → 2 h2Swin4
Dans l'industrie alimentaire transformée
Le dioxyde de soufre est utilisé comme conservateur alimentaire et stabilisateur, comme agent de contrôle de l'humidité et comme modificateur de saveur et de texture de certains produits comestibles.
Il est également utilisé pour désinfecter des équipements qui entrent en contact avec l'épicerie, les équipements de fermentation, tels que les brasseries et les contenants alimentaires, etc.
Il permet de conserver les fruits et légumes, augmente sa durée de vie sur le plateau du supermarché, empêche la perte de couleur et de saveur et d'aider à la rétention de la vitamine C (acide ascorbique) et du carotène (précurseurs de la vitamine A).
 Les fruits secs restent exempts de champignons et de bactéries grâce au SO2. Auteur: Isabel Ródenas. Source: Pixabay.com
Les fruits secs restent exempts de champignons et de bactéries grâce au SO2. Auteur: Isabel Ródenas. Source: Pixabay.com Il sert à garder le vin, car il détruit les bactéries, les champignons et les levures indésirables. Il est également utilisé pour stériliser et empêcher la formation de nitrosamines dans la bière.
 L'équipement de fermentation de l'orge pour obtenir la bière stérilise avec SO2. Auteur: Ceridebbie. Source: Pixabay.
L'équipement de fermentation de l'orge pour obtenir la bière stérilise avec SO2. Auteur: Ceridebbie. Source: Pixabay. Il est également utilisé pour tremper les grains de maïs, pour blanchir le sucre de betterave et comme antimicrobien dans la fabrication de sirop de maïs à haut fructose.
Comme solvant et réactif
Il a été largement utilisé comme solvant non aqueux. Bien qu'il ne s'agisse pas d'un solvant ionisant, il est utile comme solvant sans protons pour certaines applications analytiques et réactions chimiques.
Il est utilisé comme solvant et réactif dans l'intermédiaire organique dans la production d'autres composés tels que le dioxyde de chlore, le chlorure d'acétyle et la sulfonation de l'huile.
En tant qu'agent réducteur
Il est utilisé comme un agent réducteur malgré le fait d'être si fort, et en solution alcaline, l'ion sulfite est formé qui est un agent réducteur plus énergique.
Dans plusieurs applications
So2 Il est également utilisé:
- Dans l'agriculture comme le fongicide et le préservatif de raisin après la récolte.
- Pour fabriquer Hydrosulfite.
- Pour blanchir le bois et la pulpe de papier, car il permet de stabiliser la pulpe après le blanchiment de peroxyde d'hydrogène H2SOIT2; so2 agit en détruisant H2SOIT2 reste et donc garder la luminosité de la pulpe, comme h2SOIT2 peut provoquer une inversion de luminosité.
- Pour blanchir les fibres textiles et les articles en osier.
- Pour traiter les eaux, il élimine le chlore résiduel qui reste après la chloration de l'eau potable, des eaux usées ou des eaux industrielles.
- Dans le raffinage des minéraux et des métaux, en tant qu'agent réducteur de fer pendant le traitement des minéraux.
- Dans le raffinage de l'huile pour attraper l'oxygène et retarder la corrosion, et comme solvant d'extraction.
Peut vous servir: équilibre des équations chimiques- Comme antioxydant.
- Comme le neutralisant des alcalis dans la fabrication de verre.
- En batteries au lithium en tant qu'agent oxydant.
Effets de SO2 endogène
Certaines études ont révélé que le SO2 Endogène ou produit par l'organisme lui-même a un effet bénéfique sur le système cardiovasculaire, y compris la régulation de la fonction du cœur et la relaxation des vaisseaux sanguins.
Quand le SO se produit dans l'organisme2 Il devient ses dérivés bisulfite hso3- et sulfite donc32-, qui exerce un effet vasorelajador des artères.
So2 endogène diminue l'hypertension, empêche le développement de l'athérosclérose et protège le cœur des dommages au myocarde. Il exerce également une action antioxydante, inhibe l'inflammation et l'apoptose (mort cellulaire programmée).
Pour ces raisons, on pense que cela peut être une nouvelle thérapie possible pour les maladies cardiovasculaires.
 Le cœur peut bénéficier du SO2 produit par l'organisme. Auteur: Vecteurs d'OpenClipart. Source: Pixabay.
Le cœur peut bénéficier du SO2 produit par l'organisme. Auteur: Vecteurs d'OpenClipart. Source: Pixabay. Des risques
- Exposition à SO2 Gaseous peut entraîner des brûlures dans les yeux, la peau, la gorge et les muqueuses, les dommages aux bronches et aux poumons.
- Certaines études rapportent qu'il présente un risque potentiel de dommages au matériel génétique des cellules mammifères et humaines.
- C'est corrosif. Ce n'est pas inflammable.
Écotoxicité
Le dioxyde de soufre est le gaz polluant le plus courant dans l'atmosphère, en particulier dans les zones urbaines et industrielles.
Sa présence dans l'atmosphère contribue à la «pluie acide» si appelée qui est nocive pour les organismes aquatiques, le poisson, la végétation terrestre et la corrosion aux matériaux fabriqués par l'être humain.
 Monument endommagé par les pluies acides. Nino Barbieri [CC By-S (http: // CreativeCommons.Org / licences / by-sa / 3.0 /]]. Source: Wikimedia Commons.
Monument endommagé par les pluies acides. Nino Barbieri [CC By-S (http: // CreativeCommons.Org / licences / by-sa / 3.0 /]]. Source: Wikimedia Commons. So2 Il est toxique pour les poissons. Les plantes vertes sont extrêmement sensibles à2 atmosphérique. La luzerne, le coton, l'orge et le blé sont endommagés avec de faibles niveaux environnementaux, tandis que les pommes de terre, les oignons et le maïs sont beaucoup plus résistants.
Effets de l'ingestion avec de la nourriture
Bien qu'il soit inoffensif pour les personnes en bonne santé, lorsqu'elles sont utilisées dans les concentrations recommandées par les agences de santé autorisées, le SO2 peut induire l'asthme à des personnes sensibles qui l'ingèrent avec de la nourriture.
 Les personnes sensibles peuvent souffrir d'asthme en ingérant des aliments avec de petites quantités de SO2. Suraj à Malayalam Wikipedia [domaine public]. Source: Wikimedia Commons.
Les personnes sensibles peuvent souffrir d'asthme en ingérant des aliments avec de petites quantités de SO2. Suraj à Malayalam Wikipedia [domaine public]. Source: Wikimedia Commons. Les aliments qui contiennent généralement sont des fruits secs, des boissons gazeuses artificielles et des boissons alcoolisées.
Les références
- OU.S. Bibliothèque nationale de médecine. (2019). Dioxyde de soufre. Récupéré de pubchem.NCBI.NLM.NIH.Gouvernement.
- Huang, et. et al. (2016). Dioxyde de soufre endogène: une nouvelle douce famille de gasotransmetteurs dans le système cardiovasculaire. Longe des cellules Méd oxydes. 2016; 2016: 8961951. NCBI a récupéré.NLM.NIH.Gouvernement.
- Coton, F. Albert et Wilkinson, Geoffrey. (1980). Chimie inorganique avancée. Quatrième édition. John Wiley & Sons.
- Windholz, M. et al. (éditeurs) (1983). L'indice Merck. Une enyclopédie des produits chimiques, des médicaments et des biologiques. Dixième édition. Merck & Co., Inc.
- Pain, x. (2011). Oxydes Sulfure: sources, expositions et effets sur la santé. Effets sur la santé des oxydes de soufre. En encyclopédie de la santé environnementale. Récupéré de ScienceDirect.com.
- Tricker, R. et tricker, s. (1999). Polluants et contaminants. Le dioxyde de soufre. Dans les exigences environnementales pour l'équipement électromécanique et électronique. Récupéré de ScienceDirect.com.
- Bleat, W. (2017). Chimie acide-base. Oxydes de soufre. Dans le sol et la chimie environnementale (deuxième édition). Récupéré de ScienceDirect.com.
- Freedman, B.J. (1980). Dioxyde de soufre dans les aliments et les boissons: il utilise un conservateur et son effet sur l'asthme. Br J Dish Coffre. 1980; 14 (2): 128-34. NCBI a récupéré.NLM.NIH.Gouvernement.
- Craig, k. (2018). Un examen de la chimie, de l'utilisation des pesticides et du sort environnemental du dioxyde de soufre, comme utilisé en Californie. Dans les revues de la contamination environnementale et de la toxicologie. Volume 246. Lien récupéré.Springer.com.
- « Structure en silicium nitruro (Si3N4), propriétés, obtenant, utilisation
- Structure en polyloride en aluminium, propriétés, obtention, utilisations »

