Propriétés de Dibenzalacetona, mécanisme de réaction, utilisations, risques

- 3307
- 518
- Adam Mercier
La Dibenzalacetona (Dba) est un composé organique dont la formule moléculaire est C17H14SOIT. C'est un solide jaunâtre qui, selon sa pureté, peut être présenté sous forme de cristaux. Il est utilisé dans les écrans solaires et la synthèse organométale dans laquelle le paladium est utilisé comme catalyseur.
Bien que sa synthèse soit un processus relativement simple et assez récurrent dans les laboratoires d'enseignement pour expliquer la condensation aldolique, son mécanisme est un peu étendu, plusieurs facteurs doivent être pris en compte. Le benzaldéhyde utilisé, qui se condensera avec de l'acétone, doit être nouvellement distillé pour garantir sa faible oxydation en contact avec l'air.
 Échantillon de Dibenzalacetona dans un récipient en verre. Source: Stephanb [cc by-sa (http: // CreativeCommons.Org / licences / by-sa / 3.0 /]]
Échantillon de Dibenzalacetona dans un récipient en verre. Source: Stephanb [cc by-sa (http: // CreativeCommons.Org / licences / by-sa / 3.0 /]] De même, un milieu éthanol-eau est utilisé pour solubiliser les réactifs et, en même temps, favoriser la précipitation finale du composé de dibenzalacétone, hydrophobe et insoluble. Jusqu'à présent, on ne sait pas quels effets négatifs peuvent exercer du dibenzalaceton sur l'organisme ou l'environnement, plutôt que d'être une substance irritante.
[TOC]
Propriétés
Aspect physique
Aspect poussiéreux ou cristallin jaunâtre solide.
Masse molaire
234,29 g / mol
Isomères
La dibenzalacétone est présentée comme trois isomères géométriques: trans-trans-trans-cis et cis-cis. L'isomère trans-trans-trans est le plus stable et, par conséquent, celui qui se produit le plus pendant la synthèse.
Point de fusion
110-111 ºC. Cette gamme varie en fonction du degré de pureté du solide synthétisé.
Solubilité dans l'eau
Insoluble.
Structure
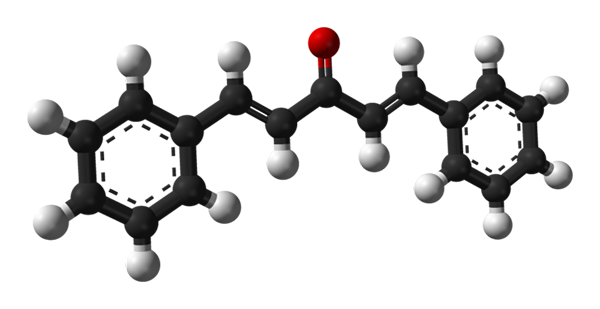 Structure moléculaire de la dibenzalacétone. Source: Benjah-Bmm27 [domaine public]
Structure moléculaire de la dibenzalacétone. Source: Benjah-Bmm27 [domaine public] Dans l'image supérieure, la molécule de l'isomère trans-trans-trans-trans est montrée. Au centre, nous avons le groupe carbonyle, et de ses côtés, doubles liais.
La dibenzalacétone est dans l'essence apolaire et hydrophobe, car toute sa structure est pratiquement composée d'atomes de carbone et d'hydrogène. Le groupe carbonyle lui donne juste un petit moment dipolaire.
Peut vous servir: phosphouro en aluminium (AIP): structure, propriétés, utilisations, risquesLa structure peut être assimilée à celle d'une feuille, car tous ses atomes de carbone ont une hybridation SP2; Par conséquent, ils reposent dans le même plan.
Les photons légers interagissent avec le système π conjugué du dibenzalacetona; en particulier ceux du rayonnement UV, absorbé pour exciter les électrons déplacés. Cette propriété fait de Dibenzalacetona un excellent absorbant de la lumière ultraviolette.
Mécanisme de réaction de Dibenzalacetona
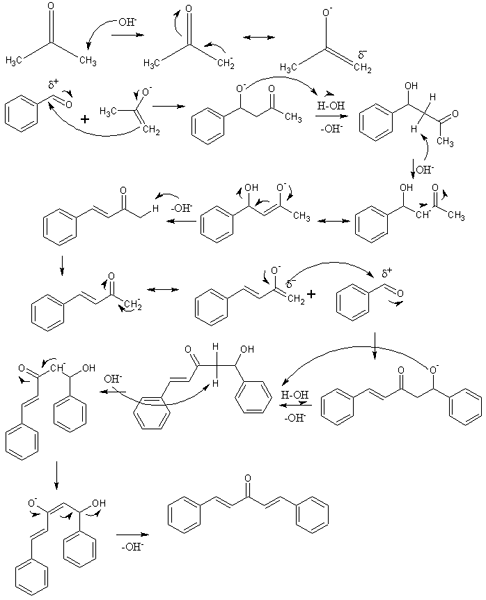 Mécanisme de condensation aldolique dans la synthèse de dibenzalacetona. Source: izmaelt [cc by-s (https: // CreativeCommons.Org / licences / by-sa / 3.0)]
Mécanisme de condensation aldolique dans la synthèse de dibenzalacetona. Source: izmaelt [cc by-s (https: // CreativeCommons.Org / licences / by-sa / 3.0)] Dans l'image supérieure, nous avons représenté le mécanisme de condensation aldolique entre le benzaldéhyde et l'acétone, pour provenir de la dibenzalacétone; Plus précisément, son isomère trans-trans.
La réaction commence par l'acétone dans le milieu de base. OH- Non gémotant un proton acide de l'un ou l'autre de ses deux groupes méthyle, -ch3, Donner naissance à un inoote: Cho3C (o) ch2-, qui déplace sa charge de résonance négative (première rangée de l'image).
Cet innoote agit alors comme un agent nucléophile: attaque le groupe carbonyle d'une molécule de benzaldéhyde. Son incorporation dans le benzaldéhyde génère un alcoxyde qui, car il est très basique dévastateur d'une molécule d'eau et devient un aldol (deuxième rangée). L'aldol ou le β-hydroxychithon se caractérise par des groupes c = o et oh.
Le milieu de base déshydrate cet aldol et une double liaison se forme dans sa structure, qui génère la benzylideneacétone (troisième rangée). Alors, oh- Également un de ses hydrogènes acides, répétant une autre attaque nucléophile sur une deuxième molécule de benzaldéhyde. Cette fois, l'attaque a lieu aussi rapidement (quatrième rangée).
Le produit a formé une autre molécule d'eau et souffre à nouveau d'une déshydratation pour éliminer le groupe OH et établir une deuxième double liaison (cinquième et sixième rangées). Ainsi et enfin, le dibenzalacetona se produit.
Peut vous servir: Boyle LawLa synthèse
Réactifs
Les réactifs pour effectuer la synthèse de la dibenzalacétone sont les suivants:
- À 95% d'éthanol.
- Benzaldéhyde nouvellement distillé d'huile d'amande amère.
- NaOH comme catalyseur de base dans l'eau distillée.
Les quantités à utiliser dépendent de la quantité de dibenzalacétone qu'elle est destinée à synthétiser. Cependant, il y a un excès de benzaldéhyde, car une partie de celle-ci est oxydée en acide benzoïque. Il est également garanti que la réaction prend moins de temps et que la benzylideneacétone indésirable est produite dans une moindre mesure.
L'éthanol agit comme un solvant de benzaldéhyde, car sinon il ne se dissoudrait pas dans l'environnement de base de NaOH.
Procédure
Dans un grand verre précipité, l'éthanol est mélangé avec du benzaldéhyde. Ensuite, le milieu de base de NaOH est ajouté pendant l'agitation magnétique constante. Dans cette étape, la réaction de Cannizzaro se produit; C'est-à-dire que deux molécules de benzaldéhyde se disproporsent dans l'un des alcools benzyliques et un autre d'acide benzoïque, facilement reconnaissable par son odeur douce caractéristique.
Enfin, de l'acétone est ajoutée et une demi-heure est attendue pour que la solution devienne nuageuse et une couleur jaune-orange. Dibenzalacetona se précipitera en raison de l'eau, donc un volume considérable d'eau est ajouté pour favoriser ses précipitations complètes.
Dibenzalacetona se filtre dans un vide et son solide jaunâtre était de la lave plusieurs fois avec de l'eau distillée.
Recristallisation
 Un échantillon recristallisé de Dibenzalacetona doit porter un éclat similaire à celui des cristaux de cette image. Source: Smokefoot [cc by-sa (https: // createVecommons.Org / licences / by-sa / 4.0)]
Un échantillon recristallisé de Dibenzalacetona doit porter un éclat similaire à celui des cristaux de cette image. Source: Smokefoot [cc by-sa (https: // createVecommons.Org / licences / by-sa / 4.0)] Pour purifier la dibenzalacétone, de l'éthanol à 95% ou de l'acétate d'éthyle chaud est utilisé, de sorte que davantage de cristaux de pureté sont obtenus pour chaque fois que la recristallisation est répétée. Ainsi, la poussière jaunâtre initiale sera transformée en petits cristaux jaunes de dibenzalacetona.
Peut vous servir: acide benzoïque (C6H5COOH)Applications
Dibenzalacetona est un composé qui n'a pas trop d'utilisations. En raison de sa capacité à absorber la lumière ultraviolette, il est utilisé dans la formulation de crème solaire, ou tout autre produit qui afflige l'incidence des rayons UV, des revêtements ou des peintures.
D'un autre côté, la dibenzalacétone est utilisée dans la synthèse organométallique du paladium. Il agit comme une liaison qui coordonne les atomes du paladium métallique, PD0, Pour former le complexe Tris (Dibenzeneacetona) Dipaladio (0).
Ce composé organométallique fournit des atomes de PD0 Dans différentes synthèses organiques, il se comporte donc comme un catalyseur homogène, car il se dissout dans de nombreux solvants organiques.
De même, DiBenzalacetona en tant que liant est facile à remplacer par d'autres liants organiques, ce qui permet à la synthèse organométallique du paladium de se développer.
Des risques
En ce qui concerne les risques, il n'y a pas beaucoup d'informations disponibles qui rapportent les impacts possibles sur la santé ou l'environnement qui peuvent conduire à la dibenzalacétone. Dans son état pur, c'est un solide irritant pour l'ingestion, la respiration ou le contact direct avec les yeux ou la peau.
Cependant, ce n'est pas suffisamment irritant pour qu'il ne puisse pas faire partie des formulations des écrans solaires. D'un autre côté, étant si insoluble dans l'eau, sa concentration en elle est négligeable, se présentant comme un solide contaminant. En ce sens, on ne sait pas à quel point il est nocif pour la faune marine ou les sols la turbidité qui cause.
Jusqu'à ce que l'inverse soit démontré.
Les références
- Morrison, R. T. Et Boyd, R, n. (1987). Chimie organique. 5e édition. Éditorial Addison-Wesley Inter-American.
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Graham Salomons t.W., Craig B. Fryhle. (2011). Chimie organique. (10e édition.). Wiley Plus.
- Wikipédia. (2020). Dibenzylideneacétone. Récupéré de: dans.Wikipédia.org
- Centre national d'information sur la biotechnologie. (2020). Dibenzylideneacétone. Base de données PubChem., CID = 640180. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement
- Synthesses organiques. (2020). Dibenzalacétone. Récupéré de: Orsyn.org
- Dibenzalacétone par condensation aldol. Récupéré de: Web.Mnstate.Édu
- « Caractéristiques de la pollution thermique, conséquences, exemples
- Fondamentaux d'iodométrie, réactions, procédure générale, utilisations »

