Dérivés halogénés

- 4227
- 743
- Adam Mercier
Nous expliquons quels sont les dérivés halogénés, leurs propriétés, les utilisations / applications et nous donnons plusieurs exemples
Que sont les dérivés halogénés?
Les dérivés halogénés Ce sont tous des composés qui ont un atome halogène; c'est-à-dire l'un des éléments du groupe 17 (f, cl, br, i). Ces éléments diffèrent des autres car ils sont plus électronégatifs, formant une diversité d'halogénures inorganiques et organiques.
L'image inférieure des halogènes est indiquée dans l'image inférieure. De haut en bas: fluorure (f2), Chlore (Cl2), Bromo (br2) et l'iode (je2). Chacun d'eux a la capacité de réagir avec la grande majorité des éléments, y compris entre les congénères du même groupe (interhalogènes).

Ainsi, les dérivés halogénés ont une formule MX s'il s'agit d'un haluro métallique, Rx s'il est alkyl et arx s'il est aromatique. Les deux derniers sont situés dans la catégorie Haluros biologique. La stabilité de ces composés nécessite un "avantage" énergétique devant la molécule de soda d'origine.
En règle générale, le fluorure se forme halogéné plus stable que l'iode. La raison est due aux différences entre leurs radios atomiques (les sphères violettes sont plus volumineuses que celles jaunes).
En augmentant le rayon atomique, le chevauchement des orbitales entre l'halogène et l'autre atome est plus pauvre et, par conséquent, le lien est plus faible.
Nomenclature
La façon de nommer correctement ces composés dépend de leur inorganique.
Inorganique
Les halogénures métalliques sont constitués d'une liaison, ionique ou covalente, entre un halogène X et un métal M (des groupes 1 et 2, des métaux de transition, des métaux lourds, etc.).
Dans ces composés, tous les halogènes ont un état d'oxydation de -1. Parce que? Parce que ses configurations de valence sont ns2NP5.
Par conséquent, ils doivent gagner un seul électron pour compléter l'octet de Valencia, tandis que les métaux s'oxydent, leur donnant les électrons qu'ils ont.
Peut vous servir: équilibre de précision: caractéristiques, fonctions, pièces, utilisationsAinsi, le fluorure reste F-, fluorure; Le CL-, chlorure; Le BR-, bromure; Et le i-, Je dure. MF serait nommé: fluorure de (nom de métal) (n), étant n le Valencia del Metal uniquement lorsqu'il en a plus. Dans le cas de groupes de groupes 1 et 2, il n'est pas nécessaire de nommer Valence.
Exemples
- NAF: fluorure de sodium.
- Cacl2: chlorure de calcium.
- AGBR: bromure d'argent.
- Zni2: Zinc Yoduro.
- CUCL: chlorure de cuivre (I).
- Cucl2: chlorure de cuivre (II).
- Ticl4: Chlorure de titane (IV) ou tétrachlorure de titano.
Cependant, l'hydrogène et les éléments non métalliques - même les mêmes halogènes - peuvent également former des haluros. Dans ces cas, le Valence du No Metal n'est pas nommé à la fin:
- PCL5: pentachlorure de phosphore.
- Petit ami3: Boro trifluoruro.
- Ali3: Triyoduro en aluminium.
- HBR: bromure d'hydrogène.
- Si7: Heptofluorure d'iode.
BIO
Que ce soit Rx ou ARX, l'halogène est lié de manière covalente à un atome de carbone. Dans ces cas, les halogènes sont mentionnés par leurs noms, et le reste de la nomenclature dépend de la structure moléculaire de R ou AR.
Pour la molécule organique la plus simple, le méthane (CHO4), Les dérivés suivants sont obtenus en remplaçant le H Cl:
- Ch3CL: chlorométhane.
- Ch2CL2: dichlorométhane.
- Chcl3: tricylorométhane (chloroforme).
- CCL4: Tétrachlorométhane (chlorure de carbone (IV) ou tétrachlorure de carbone).
Ici R se compose d'un seul atome de carbone. Ensuite, pour d'autres chaînes aliphatiques (linéaires ou branches), le nombre de carbones est compté à partir de laquelle il est lié à l'halogène:
Ch3Ch2Ch2F: 1-fluorpropano.
L'exemple précédent était celui d'un halogénure alquilical primaire. Dans le cas où la chaîne est ramifiée, la plus longue contenant l'halogène est choisie et commence à compter, laissant ce numéro possible:
Peut vous servir: quelles sont les propriétés physiques de la matière?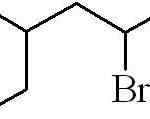
3-méthyl-5-bromohexan
De la même manière, il se produit pour d'autres substituants. De plus, pour les halogénures aromatiques, l'halogène est nommé puis le reste de la structure:

L'image supérieure montre le composé appelé bromobenzène, mettant en évidence l'atome de brome en brun.
Propriétés des dérivés halogénés
Halogénures inorganiques
Les halogénures inorganiques sont des solides ioniques ou moléculaires, bien que les premiers soient plus abondants. Selon les interactions et les radios ioniques de MX, ce sera soluble dans l'eau ou d'autres solvants moins polaires.
Les halogénures non métalliques (comme le boro) sont généralement des acides Lewis, ce qui signifie qu'ils acceptent les électrons pour former des complexes. En revanche, les halogénures (ou halogogènes) d'hydrogène dissous dans l'eau produisent ce que l'on appelle les hydracides.
Ses points de fusion, l'ébullition ou la sublimation tombent sur des interactions électrostatiques ou covalentes entre le métal ou le non-métal avec halogène.
De même, les radios ioniques jouent un rôle important dans ces propriétés. Par exemple, si m+ et x- Ils ont des tailles similaires, leurs cristaux seront plus stables.
Halogénures organiques
Ils sont polaires. Parce que? Parce que la différence d'électronégativités entre C et halogène crée un moment polaire permanent dans la molécule. De plus, cela diminue lorsque le groupe 17 descend, à partir du lien C-F avec C-i.
Sans considérer la structure moléculaire de R ou AR, les nombres halogènes croissants affectent directement les points d'ébullition, car ils augmentent la masse molaire et les interactions intermoléculaires (RC-X-X-CR). La plupart sont inquiets avec l'eau, mais ils peuvent se dissoudre dans des solvants organiques.
Utilisations de dérivés halogénés
Les utilisations des dérivés halogénés pourraient réserver leur propre texte. Les «compagnons» moléculaires moléculaires sont un facteur clé, étant donné que leurs propriétés et réactivités définissent les utilisations du dérivé.
Peut vous servir: sulfate de potassium (K2SO4): structure, propriétés, utilisations, synthèseAinsi, parmi la grande diversité des utilisations possibles, ce qui suit se démarque:
- Les halogènes moléculaires sont utilisés pour créer des ampoules halogènes, où vous contactez le filament de tungstène à incandescence. Le but de ce mélange est de réagir l'halogène X avec le tungstène évaporé. De cette façon, son dépôt est évité à la surface de l'ampoule, garantissant plus de durée de vie.
- Les sels de fluor sont utilisés dans la fluorisation des eaux dentaires et des pâtes.
- Les hypochlorites de sodium et de calcium sont deux agents actifs dans des solutions de blanchiment commerciaux (chlore).
- Bien qu'ils détériorent la couche d'ozone, les chlorofluorocarbures (CFC) sont utilisés dans les aérosols et les systèmes de refroidissement.
- Chlorure de vinyle (CHO2= Chcl) est le monomère du chlorure de polymère polyvinylique (PVC). D'un autre côté, le téflon, utilisé comme matériau non stick, se compose de chaînes polymères de tétrafluorethylène (F2C = cf2).
- Ils sont utilisés dans la chimie analytique et la synthèse organique à différentes fins; Parmi ceux-ci, la synthèse de la drogue.
Exemples supplémentaires

L'image supérieure illustre l'hormone thyroïdienne, responsable de la production de chaleur ainsi que de l'augmentation du métabolisme général dans le corps. Ce composé est un exemple de dérivé halogéné présent dans le corps humain.
Parmi d'autres composés halogénés, les éléments suivants sont mentionnés:
- Diclorodifénilricorootan (DDT), insecticide efficace mais avec de graves impacts environnementaux.
- Chlorure d'étain (snncl2), utilisé comme agent réducteur.
- Chloroéthane ou 1-chloroéthane (ch3Ch2Cl), anesthésique topique qui agit rapidement en refroidissant la peau.
- Dichloroéthylène (clch = cclh) et tétrachloréthylène (Cl2C = CCL2), utilisé comme solvants dans l'industrie du nettoyage à sec.
- « Structure chimique en carbure de silicium, propriétés et utilisations
- 80 phrases pour le premier amour qui n'oublie jamais »

