Défauts spécifiques
- 4294
- 876
- Adam Mercier
Quels sont les défauts spécifiques?
Les défauts ponctuels sont des imperfections ou des irrégularités qui sont présentées dans le réticulum cristallin d'un solide, et qui dévient la structure cristalline de son statut parfait. On dit qu'ils n'ont pas de dimension (0) car ce ne sont que des points du réticulum cristallin; Ce point peut être un atome, un ion, une molécule, des grappes, etc.
Les solides à une température de 0 K (zéro absolu) présentent des structures parfaites, car en théorie, ses composants sont immobilisés, congelés. Cependant, les atomes sont à peine téléchargés, pour dire qu'ils commencent à vibrer, qui finit tôt ou tard en déplaçant à l'extérieur de leurs sites correspondants.
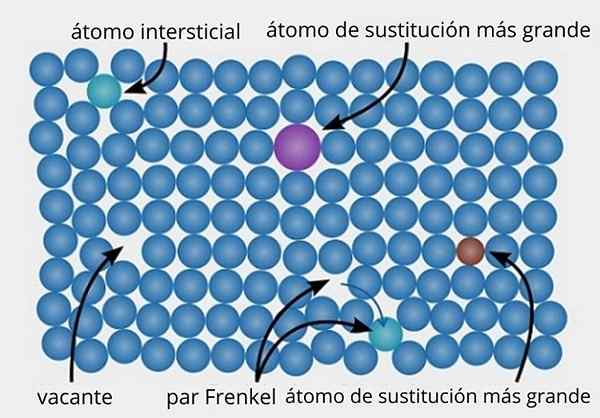
 Représentation de divers types de défauts spécifiques trouvés dans les solides cristallins. Source: Daniferi, CC BY-SA 3.0, via Wikimedia Commons
Représentation de divers types de défauts spécifiques trouvés dans les solides cristallins. Source: Daniferi, CC BY-SA 3.0, via Wikimedia Commons Voyons l'image supérieure comme un exemple. Dans une structure cristalline ordonnée et parfaite, tous les points bleuâtres doivent être alignés. Cependant, certains des points bleuâtres peuvent être absents, ce qui est observé par la présence d'un espace vide ou d'une vacance.
Si la formation de ladite vacance est due au déplacement d'un point bleuâtre de son site d'origine, nous aurons quelques Frenkel, l'un des principaux types de défauts spécifiques qui existent. Le point bleuâtre mobilisé est maintenant en position interstitielle (verte).
D'un autre côté, des défauts spécifiques peuvent également être dus à des substitutions, soit par des atomes plus grands (violets), soit des atomes plus petits (bruns) (brun). Nous parlons de défauts spécifiques substitutionnels, qui ont lieu plusieurs fois lorsque des impuretés sont introduites exprès (bordées) dans les matériaux métalliques et céramiques.
Les défauts ponctuels sont essentiels pour comprendre d'autres défauts qui sont projetés dans d'autres dimensions de verre.
Défauts spécifiques intrinsèques
Lorsqu'une structure cristalline est toujours définie, elle se fait toujours à partir de l'idéalité. Mais dans la nature, les défauts sont inévitables, aussi petits qu'ils soient. Ainsi, les solides ont une prédisposition naturelle à présenter des défauts spécifiques dans leurs structures, dont l'interaction et la sommation affectent ou modifient leurs propriétés chimiques et physiques. Les défauts spécifiques intrinsèques si appelés ont lieu dans des matériaux "purs".
Cette prédisposition naturelle est due à des facteurs thermodynamiques et cinétiques. L'introduction de défauts augmente l'entropie du solide, qui à son tour augmente avec la température. Ensuite, à une certaine température, tout solide aura un état avec une configuration minimale de défauts spécifiques.
À mesure que la température augmente, il y aura encore plus de défauts, ayant la quantité maximale possible à proximité du point de fusion. Tout cela a du sens s'il est pensé que pour des vibrations thermiques plus élevées, les chances que les atomes abandonnent leurs positions réticulaires respectives.
Point défaut extrinsèque
Contrairement aux défauts spécifiques intrinsèques, des défauts extrinsèques se produisent en raison de l'incorporation d'impuretés. Aucun solide de nature n'est 100% pur, donc ces types de défauts se manifesteront toujours, en plus de l'intrinsèque.
Peut vous servir: acide gluconique: structure, propriétés, synthèse, utilisationsCependant, ils facturent une importance et des intérêts uniques lorsque les impuretés sont intentionnellement ajoutées en quantités par défaut; Nous parlons du matériau stupide.
Selon les caractéristiques du doponte et du matériau sélectionné, les défauts sont incorporés dans le solide d'une manière prémédité, ce qui a un impact sur ses propriétés chimiques et physiques. Tel est le cas de la formulation de semi-conducteurs, par exemple, le GAAS.
D'un autre côté, des défauts spécifiques extrinsèques font également allusion à ceux qui modifient la composition de matériaux ou de solides. C'est-à-dire qu'ils perdent leur stoechiométrie pour devenir des solides non stoichiométriques.
Défauts en métal ponctuel
Dans les métaux, nous avons des cristaux qui, en principe, manquent de charges électriques; c'est-à-dire qu'il n'y a pas de cations ou d'anions présents, mais seulement des atomes neutres en métal. Ainsi, les défauts qui pourraient être dans les métaux n'affecteraient pas leur neutralité, donc aucun mécanisme n'aurait aucun mécanisme qui compense ces défauts.
 Défauts spécifiques intrinsèques dans les cristaux d'un métal hypothétique. Source: Gabriel Bolívar.
Défauts spécifiques intrinsèques dans les cristaux d'un métal hypothétique. Source: Gabriel Bolívar. Dans l'image ci-dessus, nous avons un cristal parfait et deux autres avec des défauts. Les atomes peuvent être situés dans des positions interstitielles, qui désordre des positions des atomes voisines et sont connues comme un défaut auto-interstitiel (ci-dessous au centre). Pendant ce temps, certains atomes sont capables d'abandonner leurs sites respectifs de la disposition cristalline pour générer des postes vacants (à droite).
Par conséquent, en métaux purs. Plus il y a de vacance là-bas, la densité de la substance diminue; fait qui est conforme à l'augmentation du nombre de défauts avec la température.
Quand, en revanche, le métal avec des atomes d'un autre élément est donné, ils provoquent des substitutions ou cherchent à se placer dans les interstices. Dans de tels cas, la densité métallique augmente à une valeur maximale, à partir de laquelle il commence à diminuer considérablement.
Défauts spécifiques dans les structures cristallines
Dans les structures cristallines, couvrant d'autres solides en plus des métaux susmentionnés, nous avons deux types principaux de défauts spécifiques: ceux de Frenkel et ceux de Schottky. Les deux peuvent se produire dans les mêmes régions d'un cristal, et il est également tout à fait possible qu'ils soient présents avec des défauts de postes vacants ou des occupations interstitielles.
Lorsque nous parlons de sels, d'oxydes, de sulfates, etc., Il y aura des cations et des anions qui définiront un cristal pour ses interactions électrostatiques. Par conséquent, si nous éliminons un cation, les charges négatives des anions prédomineront et le verre sera chargé négativement. C'est impossible de se produire car cela violerait le principe de l'électroneutralité.
Ainsi, les défauts de ce type de cristaux génèrent des charges électriques qui, au moyen d'un mécanisme, doivent être appariées à nouveau. Cependant, les défauts de Frenkel et Schottky ne produisent pas ce déséquilibre des charges électriques.
Peut vous servir: point d'équivalenceFrenkel
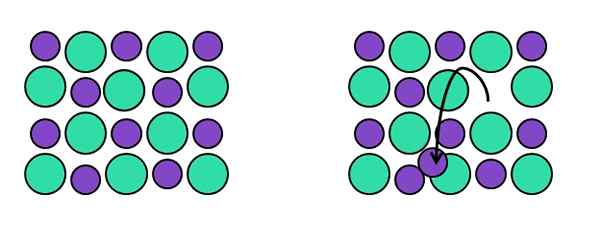 Représentation des défauts ponctuels de Frenkel. Source: Gabriel Bolívar.
Représentation des défauts ponctuels de Frenkel. Source: Gabriel Bolívar. Farm -Ran -Time Frenkel, en l'honneur de Yakov Frenkel, un point réticulaire laisse sa position d'origine pour se terminer dans un interstitium. C'est-à-dire qu'un atome, une molécule ou un ion passe à une position interstitielle laissant derrière lui une vacance.
Voir l'exemple de l'image ci-dessus. À gauche, nous avons le cristal parfait composé de deux ions: un vert, qui ordinaires à l'anion (plus volumineux), et un violet, qui devient le cation (plus petit).
Lorsque l'un des cations violets laisse leur position de la disposition cristalline, laisse une vacance derrière. Remarque sur la gauche dans laquelle la flèche noire pointe, soulignant que le cation est maintenant situé dans un interstitium.
Parce que le défaut de Frenkel se compose de déplacements (ou d'anions) de cation, le verre reste neutre. De plus, la composition du verre reste constante, car dans le réticulum, les ions changent de position: ils ne l'abandonnent pas, et d'autres ne y ajoutent pas.
Schottky
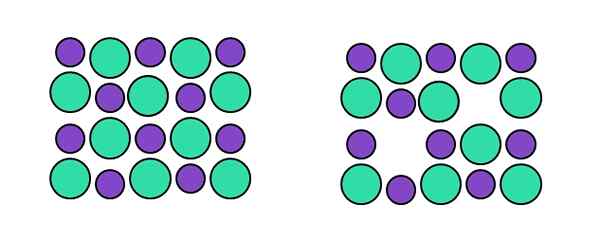 Représentation du défaut de Schottky. Source: Gabriel Bolívar.
Représentation du défaut de Schottky. Source: Gabriel Bolívar. Dans le type Schoottky spécifique, nous avons deux postes vacants simultanés: un correspondant au cation, et un autre correspondant à l'anion. Par exemple, il ne s'agit pas d'un cation pour brinque une position interstitielle, mais qu'elle "disparaît" accompagnée d'un anion (à droite de l'image supérieure).
Encore une fois, lorsque deux postes vacants sont créés en même temps, un cationique (qui se comportera comme un anion) et un anionique (qui se comportera comme un cation), la composition du cristal reste inchangée. C'est si longtemps que ce type de défaut parle, et non des postes vacants arbitraires causés par des agents externes ou internes.
De tout ce qui précède, il est conclu que les défauts de Frenkel et Shottky sont des défauts stoechiométriques de ponctuel intrinsèque, car ils ne modifient pas la composition ou la stoechiométrie des solides.
Défauts ponctuels dans les matériaux en céramique
Les céramiques sont des matériaux dont le caractère ionique est très oscillant. Certains présentent un caractère covalent marqué, comme avec la silice, sio2, ou avec l'aluminium nituro, aln.
Par conséquent, nous devons considérer deux autres types de défauts spécifiques qui peuvent se produire comme produit de la nature covalente de la céramique: l'antisitium et le lien non saturé.
Antisitium
Comme son nom l'indique, c'est le défaut qui se produit lorsque deux atomes changent leur site, étant en position contraire à celle du réticulum cristallin d'origine. Par exemple, dans le sic, il peut arriver qu'il y ait c-c ou si-si où il ne devrait pas. Ce type de défaut ponctuel est également très courant dans les alliages:
Peut vous servir: phosphouro en aluminium (AIP): structure, propriétés, utilisations, risques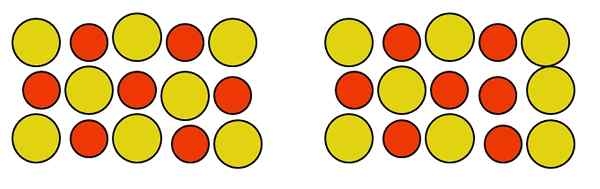 Défaut antisitium ponctuel dans un alliage Au-Cu. Source: Gabriel Bolívar.
Défaut antisitium ponctuel dans un alliage Au-Cu. Source: Gabriel Bolívar. Notez que les atomes de cuivre et d'or dans l'alliage au-comment sont neutres. Peu importe comment ils se déplacent, la neutralité du verre n'est pas dérangée. Par conséquent, les deux atomes changent de site dans le verre, comme à droite de l'image ci-dessus, cela n'affecte pas la neutralité de l'alliage.
Dans la céramique qui ont plus d'un cation, comme les épières, deux cations avec des valences égales peuvent échanger le site (par exemple pour3+ et cr3+) sans le déséquilibre des charges électriques.
Lien non saturé
Le lien non saturé (liaison pendante en anglais) interrompt l'ordre dans les cristaux de la céramique covalente, car l'atome qui forme le lien est absent, laissant quelques électrons libres.
Dans la céramique, non seulement les défauts du lien anti -itium et non saturé sont donnés, mais aussi tous les défauts intrinsèques et extrinsèques, il est donc complexe d'analyser leurs structures réelles et non parfaites.
Exemples de défauts spécifiques
Tout au long de l'article, quelques exemples de matériaux et leurs défauts spécifiques ont été mentionnés. Ensuite, et enfin, d'autres matériaux seront répertoriés, accompagnés du type de défaut qu'ils présentent habituellement.
Halogénures d'argent
Les halogénures d'argent, tels que AGCL ou AGBR, présentent des défauts de Frenkel où le cation Ag+ Il passe à des positions interstitielles.
Haluros alcalins
Les halogénures alcalins, comme le NaCl, manifestent des défauts de Schottky, dont les lacunes anioniques sont remplies d'électrons lorsque leurs cristaux sont chauffés en présence de vapeurs de sodium ou de potassium métallique.
Dioxyde de torio
Dans le tho2 Le cation th4+ est plus volumineux que l'anion ou2-. Par conséquent, cet oxyde a un défaut de frenkel où il est o2- qui passe à des positions interstitielles.
Paladio Sponge
Le paladium est capable d'absorber l'hydrogène, se comportant comme une éponge qui les conserve dans les positions interstitielles de leurs cristaux.
Aciers
De même, comme cela se produit entre le paladium et l'hydrogène, le fer peut incorporer des atomes de carbone dans ses interstices, ce qui entraîne la formation d'aciers.
Alliages en titane
Le défaut ponctuel de substitution, bien qu'il n'ait pas été expliqué comme les autres défauts, n'est rien de plus que le remplacement d'un atome pour un autre, qui se brise par l'ordre établi par le cristal.
Ainsi, par exemple, les atomes d'un cristal de titane peuvent être remplacés par d'autres atomes (métalliques) pour provoquer une famille d'alliages de titane.
Les références
- Barry Carter & M. GRANT NORTON. (2007). Science et ingénierie des matériaux en céramique. Springer.
- Fhiver & Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- B.S.H. Royce. (s.F.). Défauts ponctuels. Récupéré de: Princeton.Édu
- Wikipédia. (2020). Défaut cristallographique. Récupéré de: dans.Wikipédia.org
- Nayak, s.K., Hung, C.J., Sharma, V. et al. (2018). Aperçu des défauts ponctuels et des impuretés en titane à partir des premiers principes.NPJ Computer MA 4.11. est ce que je.org / 10.1038 / S41524-018-0068-9
- Byju's. (2020). Défauts ponctuels. Récupéré de: byjus.com

