Quelles sont les lois sur le poids de la chimie? (Exemples)

- 3211
- 498
- Lucas Schneider
Le Lois usagères de la chimie Ce sont ceux qui ont montré que les masses des substances qui réagissent ne le font pas arbitrairement ou au hasard; mais maintenir une proportion mathématique constante de nombres entiers ou de sous-cultiples, dans lesquels les atomes des éléments ne sont pas créés ou détruits.
Dans les temps passés, établir ces lois nécessitait des efforts extraordinaires de raisonnement; Parce que bien que maintenant, il semble trop évident, avant que les masses atomiques ou moléculaires des éléments ou des composés n'étaient même connues, respectivement.
 Source: Jeff Keyzer d'Austin, TX, USA [CC BY-SA 2.0 (https: // CreativeCommons.Org / licences / by-sa / 2.0)]
Source: Jeff Keyzer d'Austin, TX, USA [CC BY-SA 2.0 (https: // CreativeCommons.Org / licences / by-sa / 2.0)] Comme on ne savait pas comment une mole d'atomes de chaque élément était équivalente, les produits chimiques des XVIIIe et XIXe siècles devaient être basés sur les masses réagissantes. De sorte que les échelles analytiques rudimentaires (image supérieure) étaient des compagnons inséparables au cours des centaines d'expériences nécessaires au règlement des lois de pondération.
C'est pour cette raison que lorsque ces lois de la chimie sont étudiées, ils sont tombés sur des mesures de masse à chaque instant. Grâce à cela, en extrapolant les résultats des expériences, il a été découvert que les composés chimiques Pur Ils se forment toujours avec la même proportion de masse de leurs éléments constitutifs.
[TOC]
Loi de conservation de masse
Cette loi indique que dans une réaction chimique, la masse totale des réactifs est égale à la masse totale des produits; Tant que le système considéré est fermé et qu'il n'y a pas d'échange de masse et d'énergie avec son environnement.
Dans une réaction chimique, les substances ne disparaissent pas, mais sont transformées en autres substances de masse égale; De là, la célèbre phrase: "Rien n'est créé, rien n'est détruit, tout est transformé".
Historiquement, la loi de la conservation de masse dans une réaction chimique a été proposée pour la première fois en 1756 par Mikhail Lomonsov, qui a montré dans son journal les résultats de ses expériences.
Par la suite, en 1774, Antoine Levoisier, chimiste français, a présenté les résultats de ses expériences qui ont permis de l'établir; qui, certains l'appellent également la loi de Lavoisier.
-Expériences lavoisier
À l'époque de Lavoisier (1743-1794), il y avait la théorie de la flogisto, selon laquelle les corps avaient la capacité de gonfler ou de brûler. Des expériences Lavoisier ont permis de jeter cette théorie.
Lavoisier a effectué de nombreuses expériences de combustion en métal. Il a soigneusement pesé les matériaux avant et après sa combustion dans un récipient fermé, constatant qu'il y avait un gain de poids apparent.
Mais Lavoir, basé sur la connaissance du rôle de l'oxygène dans la combustion, a conclu que le gain de poids dans la combustion était dû à l'incorporation de l'oxygène dans les matériaux de combustion. Le concept d'oxydes métalliques est né.
Par conséquent, la somme des masses des métaux soumises à la combustion et à l'oxygène est restée inaltérable. Cette conclusion a permis la création de la loi sur la conservation de masse.
-Équation des équations
La loi sur la conservation de masse a établi la nécessité d'équilibrer les équations chimiques, garantissant que le nombre de tous les éléments impliqués dans une réaction chimique, ainsi que des réactifs ou des produits, est exactement le même.
Il s'agit d'une exigence essentielle pour la précision des calculs stoechiométriques qui sont effectués.
-Calculs
Moles d'eau
Combien de moles d'eau peuvent se produire pendant la combustion de 5 moles de méthane dans un excès d'oxygène? Démontre également que la loi de la conservation de la matière est accomplie.
Ch4 + 2 o2 => CO2 + 2 h2SOIT
En observant l'équation équilibrée de la réaction, il est conclu que 1 mol de méthane produit 2 moles d'eau.
Le problème peut être résolu directement avec une approche simple, car nous n'avons pas de 1 mol mais 5 moles de Cho4:
Moles d'eau = 5 moles de cho4· (2 moles de h2O / 1 mol de Cho4)
= 10
Ce qui équivaudrait à 180 g de h2SOIT. 5 mols ou 220 g de CO ont également été formés2, qui est égal à une masse totale de 400 g de produits.
Ainsi, pour la loi de la conservation du sujet à réagir 400 g de réactifs; ni plus ni moins. De ces 400 g, 80 g correspondent aux 5 moles de cho4 (en multipliquant par sa masse moléculaire de 16 g / mol) et 320 g à 10 moles de o2 (De même en raison de sa masse moléculaire de 32 g / mol).
Combustion d'un ruban de magnésium
Un ruban de magnésium de 1,50 g brûlé dans un récipient fermé contenant 0,80 g d'oxygène. Après combustion, 0,25 g d'oxygène était dans le récipient. a) Quelle masse d'oxygène a réagi? b) Quelle a été formé de l'oxyde de magnésium?
Peut vous servir: Solution hypotonique: composants, préparation, exemplesLa masse d'oxygène qui a réagi est obtenue par une simple différence.
Masse d'oxygène consommée = (masse initiale - masse résiduelle) oxygène
= 0,80 g - 0,25 g
= 0,55 g ou2 (pour)
Selon la loi sur la conservation de masse,
Masse d'oxyde de magnésium = masse de magnésium + masse d'oxygène
= 1,50 g + 0,55 g
= 2,05 g Mgo (b)
Loi des proportions définies
Joseph Louis Proust (1754-1826), chimiste français, s'est rendu compte que dans une réaction chimique, les éléments chimiques réagissent toujours dans des proportions de masse fixe pour former un composé pur spécifique; Par conséquent, sa composition est constante, quelle que soit la source ou l'origine, ou comment elle est synthétisée.
Proust a déclaré en 1799 la loi des proportions définies, qui stipule que: "Lorsque deux ou plusieurs éléments sont combinés pour former un composé, ils le font dans une relation de masse fixe". Ainsi, cette relation est fixée et ne dépend pas de la stratégie suivie pour la préparation du composé.
Cette loi est également connue comme la loi de la composition constante, qui stipule que: "chaque composé chimique en pureté contient toujours les mêmes éléments, dans une proportion constante de masse".
-Illustration de la loi
Le fer (foi) réagit avec le (s) soufre pour former du sulfure de fer (FE), trois situations peuvent être indiquées (1, 2 et 3):
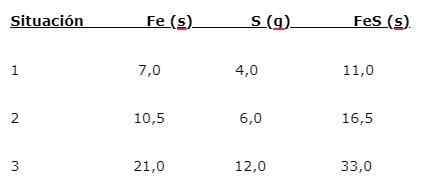
Pour trouver la proportion dans laquelle les éléments sont combinés, la masse principale (foi) est divisée par la ou les masse mineure (s). Le calcul donne une proportion de 1,75: 1. Cette valeur est répétée dans les trois conditions données (1, 2 et 3), où la même proportion est obtenue bien que différentes masses soient utilisées.
C'est-à-dire que 1,75 g de foi sont combinés avec 1,0 g de s pour donner 2,75 g de FE.
-Applications
Grâce à l'application cette loi, vous pouvez connaître exactement les masses des éléments qui doivent être combinés pour obtenir une masse souhaitée d'un composé.
De cette façon, des informations sur la masse restante de l'un des éléments impliqués dans une réaction chimique peuvent être obtenus, ou s'il existe un réactif limitant dans la réaction.
De plus, il s'applique à connaître la composition centimale d'un composé, et sur la base de ce dernier, la formule d'un composé peut être établie.
COMPOSITION CENTÉSIMALE d'un composé
Dioxyde de carbone (CO2) est formé dans la réaction suivante:
C + O2 => CO2
12 g de carbone 32 g d'oxygène sont combinés pour donner 44 g de dioxyde de carbone.
Ainsi, le pourcentage de carbone est égal à
Pourcentage de carbone = (12 g / 44 g) · 100%
= 27,3%
Pourcentage d'oxygène = (32 g / 44 g) · 100%
Pourcentage d'oxygène = 72,7%
En utilisant l'énoncé de la loi de la composition constante, on peut noter que le dioxyde de carbone est toujours formé par 27,3% de carbone et 72,7% d'oxygène.
-Calculs
Trioxyde de soufre
En réagissant dans différents récipients 4 g et 6 g de soufre (s) avec de l'oxygène (O), ils ont été obtenus, respectivement, 10 g et 15 g de trioxyde de soufre (donc3).
Pourquoi de telles quantités de trioxyde de soufre et pas d'autres?
Calculez également la quantité de soufre nécessaire pour combiner avec 36 g d'oxygène et la pâte trioxyde de soufre obtenue.
Partie A)
Dans le premier récipient, 4 g g d'oxygène sont mélangés pour obtenir 10 g de trioxyde. Si la loi sur la conservation de la masse est appliquée, nous pouvons effacer la masse d'oxygène combinée avec du soufre.
Masse d'oxygène = 10 g de trioxyde d'oxygène - 4 g de soufre.
= 6 g
Dans le récipient 2 6 g de soufre sont mélangés avec X g d'oxygène pour obtenir 15 trioxyde de soufre.
Masse d'oxygène = 15 g de trioxyde de soufre - 6 g de soufre
= 9 g
Les proportions O / S pour chaque conteneur sont ensuite calculées:
Proportion o / s dans la situation 1 = 6 g o / 4 g s
= 1,5 / 1
Proportion o / s dans la situation 2 = 9 g o / 6 g s
= 1,5 / 1
Qui, est d'accord avec ce qui est soulevé dans la loi des proportions définies indiquant que les éléments sont toujours combinés dans la même proportion pour former un certain composé.
Par conséquent, les valeurs obtenues sont correctes et celles qui correspondent à l'application de la loi.
Partie b)
Dans la section précédente, une valeur de 1,5 / 1 a été calculée pour la proportion O / S.
Peut vous servir: états de l'agrégation de la matièreg de soufre = 36 oxygène · (1 g de soufre / 1,5 g d'oxygène)
= 24 g
g de trioxyde de soufre = 36 g d'oxygène + 24 g de soufre
= 60 g
Chlore et magnésium
Le chlore et le magnésium sont combinés dans la proportion de 2,95 g de chlore pour chaque g de magnésium. a) Déterminer les masses de chlore et de magnésium nécessaires pour obtenir 25 g de chlorure de magnésium. b) Quelle est la composition en pourcentage du chlorure de magnésium?
Partie A)
Sur la base de la valeur de 2,95 pour le rapport CL: MG, l'approche suivante peut être réalisée:
2,95 g de CL +1 g de mg => 3,95 g de mgcl2
Alors:
G de CL = 25 g de MGCL2 · (2,95 g Cl / 3,95 g Mgcl2)
= 18,67
G de mg = 25 g de mgcl2 · (1 g mg / 3,95 g mgcl2)
= 6,33
Ensuite, 18,67 g de chlore sont combinés avec 6,33 g de magnésium pour produire 25 g de chlorure de magnésium.
Partie b)
La masse moléculaire du chlorure de magnésium, le MGCL est calculé en premier2:
Poids moléculaire MGCL2 = 24,3 g / mol + (2 · 35,5 g / mol)
= 95,3 g / mol
Pourcentage de magnésium = (24,3 g / 95,3 g) x 100%
= 25,5%
Pourcentage de chlore = (71 g / 95,3 g) x 100%
= 74,5%
Loi des proportions multiples ou loi de Dalton
La loi a été déclarée en 1803 par le chimiste français et météorologue John Dalton, sur la base de ses observations concernant les réactions des gaz atmosphériques.
La loi a été indiquée comme suit: "Lorsque les éléments sont combinés pour donner plus d'un composé, une masse variable de l'un d'eux rejoint une masse fixe de l'autre et la première a une relation de canons et de nombres indistincts".
Aussi: "Lorsque deux éléments sont combinés pour provoquer différents composés, étant donné une quantité fixe de l'un d'eux, les différentes quantités de l'autre élément qui sont combinées avec cette quantité fixe pour produire les composés, sont en relation avec des nombres entiers simples".
John Dalton a fait la première description moderne de l'atome en tant que composant des éléments chimiques, lorsqu'il a souligné que les éléments sont formés par des particules indivisibles appelées atomes.
De plus, il a postulé que les composés se forment lorsque des atomes d'éléments différents se combinent dans les proportions d'entiers simples.
Dalton a terminé les travaux de recherche de Proust. Il a souligné l'existence de deux oxydes d'étain, avec des pourcentages de 88,1% et 78,7% de l'étain avec les pourcentages correspondants d'oxygène, 11,9% et 21,3%, respectivement.
-Calculs
Eau et peroxyde d'hydrogène
Montrer que les composés d'eau, h2Ou, et peroxyde d'hydrogène, h2SOIT2, Ils se conforment à la loi de plusieurs proportions.
Poids atomiques des éléments: H = 1 g / mol et oxygène = 16 g / mol.
Pesos moléculaires des composés: h2O = 18 g / mol et h2SOIT2 = 34 g / mol.
L'hydrogène est l'élément avec une quantité fixe en h2Ou et h2SOIT2, Ainsi, les proportions entre O et H seront établies dans les deux composés.
Ratio O / H en H2O = (16 g / mol) / (2 g / mol)
= 8/1
Ratio O / H en H2SOIT2 = (32 g / mol) / (2 g / mol)
= 16/1
Relation entre les deux proportions = (16/1) / (8/1)
= 2
Ensuite, le rapport de l'Or / H entre le peroxyde d'hydrogène et l'eau est de 2, un entier et un nombre simple. Il y a une conformité démontrée à la loi de plusieurs proportions.
Oxydes d'azote
Quelle masse d'oxygène est combinée avec 3,0 g d'azote dans A) oxyde nitrique, NO et B) dioxyde d'azote, non2. Montrez que non et non2 Ils se conforment à la loi de plusieurs proportions.
Masse d'azote = 3 g
Poids atomiques: azote, 14 g / mol, et oxygène, 16 g / mol.
Calculs
Dans le NO, un atome de n est combiné avec 1 atome d'O, de sorte que la masse d'oxygène combinée avec 3 g d'azote peut être calculée par l'approche suivante:
G de o = g azote · (pa. O / PA. N)
= 3 g · (16 g / mol / 14 g / mol)
= 3,43 g ou
Dans le non2, Un atome de n est combiné avec 2 atomes d'O, de sorte que la masse d'oxygène combinée est:
g d'oxygène = 3 g · (32 g / mol / 14 g / mol)
= 6,86 g ou
Proportion o / n à no = 3,43 g o / 3 g n
= 1 143
Proportion ou / n dans non2 = 6,86 g o / 3 g n
= 2 282
Valeur de la relation entre les proportions O / N = 2 282 / 1,143
= 2
Ensuite, la valeur de la relation entre les proportions ou / n est 2, un entier et un numéro simple. Par conséquent, la loi des proportions multiples est remplie.
Loi des proportions réciproques
Cette loi formulée par Richter et Carl F. Wenzel séparé.
Peut vous servir: sodium: histoire, structure, propriétés, risques et utilisationsPar exemple, si vous avez les deux composés AB et CB, il est observé que l'élément commun est b.
La loi ou les proportions réciproques de Richter-Wenzel dit que, sachant à quel point une réagsionnerie avec B pour donner AB, et combien C réagit avec B pour donner CB, vous pouvez calculer la masse dont il est nécessaire pour réagir avec une masse C à pour Mac.
Et le résultat est que la proportion de: C ou A / C doit être un multiples ou un sous-maître de A / B ou C / B. Cependant, cette loi n'est pas toujours remplie, surtout lorsque les éléments présentent plusieurs états d'oxydation.
De toutes les lois sur le poids, c'est peut-être le plus "abstrait" ou compliqué. Mais s'il est analysé d'un point de vue mathématique, on verra qui se compose uniquement de facteurs de conversion et d'annulation.
-Exemples
Méthane
Si on sait que 12 g de carbone réagissent avec 32 g d'oxygène pour former du dioxyde de carbone; et que, en revanche, 2 g d'hydrogène réagissent avec 16 g d'oxygène pour former l'eau, puis les proportions de masse c / o et h / ou pour le CO peuvent être estimées2 et h2Ou, respectivement.
Calcul de C / O et H / ou vous avez:
C / o = 12g c / 32g ou
= 3/8
H / o = 2g h / 16g ou
= 1/8
L'oxygène est l'élément commun, et il est souhaité de savoir combien de carbone réagit avec l'hydrogène pour produire du méthane; C'est-à-dire que vous souhaitez calculer C / H (ou H / C). Ensuite, il est nécessaire de faire une division des proportions précédentes pour démontrer si la réciprocité est remplie ou non:
C / h = (c / o) / (h / o)
Notez que de cette manière le système d'exploitation est annulé et que C / H reste:
C / h = (3/8) / (1/8)
= 3
Et 3 est un multiple 3/8 (3/8 x 8). Cela signifie que 3 g de C réagit avec 1 g de h pour donner du méthane. Mais, pour pouvoir le comparer avec le CO2, Il est multiplié C / H par 4, qui est égal à 12; Cela donne 12 g de C qui réagit avec 4 g de h pour former du méthane, ce qui est également vrai.
Sulfure de magnésium
Si on sait que 24 g de magnésium réagissent avec 2 g d'hydrogène pour former l'hydrure de magnésium; Et en outre, 32 g de soufre réagissent avec 2 g d'hydrogène pour former du sulfure d'hydrogène, l'élément en commun est l'hydrogène et veut calculer les mg / s à partir de mg / h et h / s.
Calculant ensuite Mg / H et H / S séparément vous avez:
Mg / h = 24g mg / 2g h
= 12
H / s = 2g h / 32g s
= 1/16
Cependant, il est pratique d'utiliser S / H pour annuler H. Par conséquent, S / H est égal à 16. Cela fait, nous procédons à calculer les mg / s:
Mg / s = (mg / h) / (s / h)
= (12/16)
= 3/4
Et 3/4 est un paramètre de 12 (3/4 x 16). La proportion Mg / s indique que 3 g de Mg réagissent avec 4 g de soufre pour former du sulfure de magnésium. Cependant, vous devez multiplier Mg / S par 8 pour pouvoir le comparer avec Mg / H. Ainsi, 24 g de Mg réagissent avec 32 g de soufre pour donner ce sulfure métallique.
Chlorure d'aluminium
Il est connu que 35,5 g de CL réagit avec 1 g de h pour former HCl. De plus, 27 g d'Al réagissent avec 3 g de h pour former ALH3. Calculez la proportion de chlorure d'aluminium et dites si un tel composé obéit à la loi de Richter-Wenzel.
Encore une fois, Cl / H et AT / H sont calculés séparément:
Cl / H = 35,5 g Cl / 1g H
= 35,5
À / h = 27g à / 3g h
= 9
Maintenant, il est calculé à / cl:
At / cl = (al / h) / (cl / h)
= 9/35,5
≈ 0,250 ou 1/4 (il est en fait 0,253)
C'est-à-dire que 0,250 g d'Al réagit avec 1 g de Cl pour former le sel correspondant. Mais, encore une fois, il doit être multiplié en / Cl par un nombre qui permet de le comparer (pour le confort) avec Al / H.
Impréciations dans le calcul
Il est ensuite multiplié en / cl par 108 (0,27 / 250), donnant 27 g dont il réagit avec 108 g de Cl. Cela ne se produit pas précisément. Si nous prenons par exemple la valeur de 0,253 par Al / Cl, et que nous le multiplions par 106,7 (27 / 0,253), 27 g d'Al réagit avec 106,7 g de CL; Ce qui, il s'approche davantage de la réalité (Alcl3, avec un PA de 35,5 g / mol pour le CL).
Ici, on observe comment la loi de Richter peut commencer à étancher en raison de la précision et de l'utilisation abusive des décimales.
Les références
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning.
- Fleurs, J. Chemistry (2002). Éditorial de Santillana.
- Joaquín San Frutos Fernández. (s.F.). Le poids et les lois volumétriques. Récupéré de: Encina.pntique.MEC.est
- Toppr. (s.F.). Lois de combinaison chimique. Récupéré de: toppr.com
- Brillant. (2019). Lois de combinaison chimique. Récupéré de: brillant.org
- CHIMISTER BOOLISTexts. (15 juillet 2015). Lois chimiques fondamentales. Récupéré de: Chem.Bibliothèque.org
- Helmestine, Anne Marie, Ph.D. (18 janvier 2019). Loi de conservation de masse. Récupéré de: Thoughtco.com
- « Conquête de la découverte de la Colombie, des étapes, des conséquences
- 9 TRAVAILLEMENT DE TRAVAIL DE LA CARRIÈRE DE L'ADMINISTRATION DES BUSITIFS »

