Chrome (CR)

- 4211
- 682
- Anaïs Julien
 Chrome est un métal très réactif. Wikimedia Commons
Chrome est un métal très réactif. Wikimedia Commons Qu'est-ce que Chrome?
Il chrome (CR) est un élément chimique du groupe 6 (VIB) du tableau périodique. Annuellement des tonnes de ce métal sont produites par extraction de chromite ou de magnésium minéral (Fecr2SOIT4, MGCR2SOIT4), qui sont réduits avec du charbon pour obtenir du métal. Il est très réactif, et seulement dans des conditions très réductrices, il est sous sa forme pure.
Ses minéraux et oxydes, ainsi qu'une minuscule portion de cuivre métallique, font occuper cet élément le numéro 22 des plus abondants du cortex de la Terre.
La chimie du chrome est très diversifiée car elle peut former des liens avec presque l'ensemble du tableau périodique. Chacun de ses composés présente des couleurs qui dépendent du numéro d'oxydation, ainsi que des espèces qui interagissent avec elle.
En outre, former des liens vers le carbone, intervenant dans un grand nombre de composés organométaux.
Caractéristiques et propriétés chromées
Le chrome est un métal argenté sous sa forme pure, avec un numéro atomique 24 et un poids moléculaire d'environ 52 g / mol (52Cr, son isotope le plus stable).
Compte tenu de ses liaisons métalliques fortes, il présente des points de fusion (1907 ºC) et l'ébullition (2671 ºC) haut. De plus, sa structure cristalline en fait un métal très dense (7.19 g / ml).
Il ne réagit pas avec l'eau pour former des hydroxydes, mais avec les acides. Il s'oxyde avec l'oxygène de l'air produisant généralement de l'oxyde chromique, qui est un pigment vert largement utilisé.
Ces couches d'oxyde créent ce que l'on appelle Passivation, Protéger le métal contre les corrosions ultérieures, car l'oxygène ne peut pas pénétrer le sinus métallique.
Sa configuration électronique est [ar] 4s13D5, Avec tous les électrons manquants et, par conséquent, il présente des propriétés paramagnétiques. Cependant, l'accouplement des tours électroniques peut se produire si le métal est soumis à de basses températures, acquérant d'autres propriétés, comme l'antitiferromagnétisme.
Peut vous servir: matériaux réfractairesStructure chimique chromée
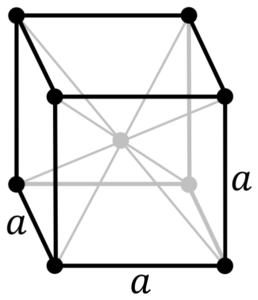 Structure de métal chromé. Source: par PNG original de Daniel Mayer, DBOB, Wikimedia Commons
Structure de métal chromé. Source: par PNG original de Daniel Mayer, DBOB, Wikimedia Commons Quelle est la structure du métal chromé? Dans sa forme pure, le chrome adopte une structure cristalline cubique centrée sur le corps (CC ou BCC). Cela signifie que l'atome chromé est situé au centre d'un cube, dont les bords sont occupés par d'autres chromes (comme dans l'image supérieure).
Cette structure est responsable du chrome possédant des points de fusion et d'ébullition élevés, ainsi que de grande dureté. Les atomes de cuivre chevauchent leurs orbitales S et D pour former des bandes de conduite selon la théorie des bandes.
Ainsi, les deux bandes sont pleines en deux parce que leur configuration électronique est [AR] 4S13D5, Et en tant qu'orbital s, peut abriter deux électrons et les orbitales de dix. Ensuite, seule la moitié des bandes formées par leurs chevauchements sont occupées par des électrons.
Avec ces deux perspectives - La structure cristalline et le lien métallique - de nombreux propriétés physiques de ce métal peuvent être expliquées en théorie. Cependant, ni l'un ni l'autre explique pourquoi Chrome peut avoir plusieurs états ou des nombres d'oxydation.
Pour cela, une compréhension approfondie de la stabilité de l'atome en ce qui concerne les tours électroniques.
Numéro d'oxydation chromé
Parce que la configuration électronique chromée est [ar] 4s13D5 Vous pouvez gagner jusqu'à un ou deux électrons (CR1- et cr2-), ou les perdre pour acquérir différents nombres d'oxydation.
Ainsi, si le chrome perd un électron, ce serait comme [ar] 4S03D5; Si vous en perdez trois, [ar] 4s03D3; Et si vous les perdez tous, [Ar], ou ce qui est la même.
Peut vous servir: point d'ébullition: concept, calcul et exemplesLe chrome ne perd ni ne gagne ni ne gagne des électrons en raison du simple gquie: il doit y avoir une espèce qui les a fait ou les accepter pour passer d'un numéro d'oxydation à un autre.
Le chrome a les numéros d'oxydation suivants: -2, -1, 0, +1, +2, +3, +4, +5 et +6. D'entre eux le +3, cr3+, C'est le plus stable et donc le prédominant de tous; suivi de +6, cr6+.
Chrome utilise
Comme colorant ou pigment
Le chrome a un large éventail d'applications, du colorant pour différents types de tissus, au protecteur qui embellit les pièces métalliques, dans ce qui est connu sous le nom de chromé, qui peut être fait avec du métal pur, ou avec des composés Cr (III) ou CR (Vi).
Cromic Fluoruro (CRF3), par exemple, il est utilisé comme colorant pour les tissus de laine; Sulfate cromique (Cr2(SW4)3), il est destiné à colorer les émaux, la céramique, les peintures, les encres, les vernis et sert également aux métaux chromaires; et l'oxyde chromique (Cr2SOIT3) Trouvez également une utilisation où sa couleur verte attrayante est requise.
Par conséquent, tout minéral chromé aux couleurs intenses peut être destiné à teindre une structure, mais après cela, si ces composés sont dangereux ou non pour l'environnement ou pour la santé des individus.
En fait, ses propriétés toxiques sont utilisées pour conserver le bois et d'autres surfaces d'attaque d'insectes.
En chromé ou en métallurgie
De même, de petites quantités de chrome à l'acier sont ajoutées pour la renforcer face à l'oxydation et pour améliorer sa luminosité. C'est parce qu'il est capable de former des carbures gris (CR3C2) Très résistant lorsque vous réagissez avec l'oxygène de l'air.
Peut vous servir: hydroxyde de calcium (CA (OH) 2): structure, propriétés, obtention, utilisationsParce que le chrome peut polir jusqu'à des surfaces vives, Chrome présente ensuite des conceptions et des couleurs argentées comme une alternative moins chère à ces fins.
Nutritionnel
Un certain débat si le chrome peut être considéré comme un élément essentiel, c'est-à-dire indispensable dans le régime alimentaire quotidien. Il est présent dans certains aliments en très petites concentrations, comme les feuilles vertes et les tomates.
Il existe également des suppléments de protéines qui régulent l'activité de l'insuline et favorisent la croissance musculaire, comme c'est le cas avec chrome polynicotinato.
Où est le chrome?
Le chrome se trouve dans une grande variété de minéraux et de gemmes, comme les rubis et les émeraudes. Le minéral principal à partir duquel le chrome est extrait est la chromite (MCR2SOIT4), Où m peut être tout autre métal avec lequel l'oxyde de chrome est associé. Ces mines abondent en Afrique du Sud, en Inde, en Turquie, en Finlande, au Brésil et dans d'autres pays.
Chaque source a une ou plusieurs variantes de chromite. De cette façon, pour chaque m (foi, mg, mn, zn, etc.) Un minéral chromé différent survient.
Pour extraire le métal, c'est nécessaire. Cela se fait avec du carbone ou de l'aluminium:
Faire un coup de fouet2SOIT4 + 4C => Fe + 2cr + 4CO
De même, la Chromita est trouvée (PBCRO4).
Habituellement, dans n'importe quel minéral où l'ion Cr3+ peut remplacer Al3+, Les deux avec des radios ioniques légèrement similaires, constituent une impureté qui se traduit par une autre source naturelle de ce métal étonnant mais nocif.
Les références
- Tenebaum e. Chrome. Tiré de: chimie.Pomona.Édu
- CHIMISTER BOOLISTexts. Chimie du chrome. Tiré de: Chem.Bibliothèque.org
- Chrome. Tiré de: Chemistry-explaed.com

