Coulombimétrie fondamentaux, types, applications

- 3079
- 748
- Justine Charpentier
La Coulombimétrie Il s'agit d'une technique d'analyse électrochimique qui consiste à effectuer une électrolyse exhaustive, afin que l'analyte puisse être quantifié; c'est-à-dire pour déterminer la concentration de l'analyte dans les problèmes des problèmes grâce à son oxydation ou à sa réduction complète. C'est, contrairement à la potentiométrie, une technique dynamique, car le courant peut circuler librement à travers les cellules électrochimiques.
Comme son nom l'indique, la charge électrique Q, dans les unités de Coulomb, C, est mesurée et corrélée avec la concentration de l'analyte oxydé ou réduit dans les périphéries d'électrode. Par conséquent, les états d'oxydation de l'analyte changent, se produisant dans le processus un transfert et une absorption des électrons qui permet le calcul stœchiométrique de la concentration souhaitée.
 Assemblage rudimentaire pour une électrolyse dans laquelle plusieurs espèces colorées se forment en raison du pH et de la complexation des forestiers présents. Source: Steve Jurvetson de Menlo Park, États-Unis, CC par 2.0, via Wikimedia Commons
Assemblage rudimentaire pour une électrolyse dans laquelle plusieurs espèces colorées se forment en raison du pH et de la complexation des forestiers présents. Source: Steve Jurvetson de Menlo Park, États-Unis, CC par 2.0, via Wikimedia Commons Dans la coulombimétrie, une batterie ou un potentiostat est utilisé pour contrôler le courant ou le potentiel appliqué aux cellules. Ces cellules, contrairement à celles potentiométriques, sont constituées d'un système à trois électrodes et sont équipées d'un voltmètre et d'un ampère.
Coulombimétrie présente l'avantage de pouvoir effectuer des diplômes sans préparer ou normaliser les modèles. Il permet également de quantifier des quantités d'analytes très petites et limitées, telles que des cations métalliques, des composés inorganiques et des composés organiques. Par exemple, il y a un coulomètre conçu exclusivement pour mesurer le CO2 dissous dans des échantillons de l'océan.
Cette technique offre un itinéraire analytique différent de celui volumétrique et potentiométrique, de nombreuses analyses, selon la nature électrochimique de l'analyte, peuvent se développer de manière coulombimétrique.
Fondements théoriques de la coulombimétrie
Loi de faraday
La coulombimétrie est basée sur la loi de Faraday, qui établit une relation entre la charge électrique d'une cellule électrochimique et la quantité d'analyte qui s'oxyde ou réduit. Connaître cette charge Q, ainsi que la charge d'un électron (1.6 · 10-19 C), vous pouvez calculer le nombre d'électrons impliqués dans une réaction, net-:
net- = Q / E
D'un autre côté, on sait qu'une mole d'électrons (6.02 · 1023) Porta une charge électrique égale à 96485 C, une figure connue sous la constante constante de Faraday:
F = dansPOUR
= 96485.3365 c / mol
Être pratique pour exprimer la quantité d'électrons en fonction des grains. Grâce à cela, les coefficients stœchiométriques d'une réaction électrochimique peuvent être utilisés, être de l'oxydation ou de la réduction, en tenant compte du nombre de moles d'électrons ou perdent l'espèce.
Peut vous servir: phosphate de sodium: structure, propriétés, synthèse, utilisationsCalculs de base
Par exemple, considérez l'équation chimique suivante:
Bœuf + 2e- → Réseau
Mesurer que lorsque toute l'espèce de bœuf a été réduite à un réseau, nous pouvons calculer les moles de bœuf en utilisant des facteurs de conversion:
xq · (mol e- / 96485.3365 c) · (mol ox / 2mol e-) = mol ox
Autrement dit, comme nous connaissons la charge électrique pour une mol d'électrons, nous aurons combien d'électrons correspondent à la charge xq. Mais à son tour, toutes les 2 moles de ces électrons sont utilisées pour oxyder 1 mol de bœuf.
Ce raisonnement provoque une formule directe, même s'il n'est pas recommandé de le mémoriser, mais de pouvoir le déduire comme cela a été fait:
n = Q / (fñet-)
Où ñet- C'est le nombre de moles d'électrons dans l'équation chimique.
À condition qu'il puisse être calculé Q, quel que soit le type de coulombimétrie, les moles du bœuf ou de l'analyte de réseau peuvent être déterminées; Tant que l'efficacité du courant est 100%. Ce dernier signifie que toute la charge qui doit être le produit d'une seule transformation, sans que d'autres espèces ne soient réduites ou oxydées.
Fondations expérimentales de la coulombimétrie
Cellules
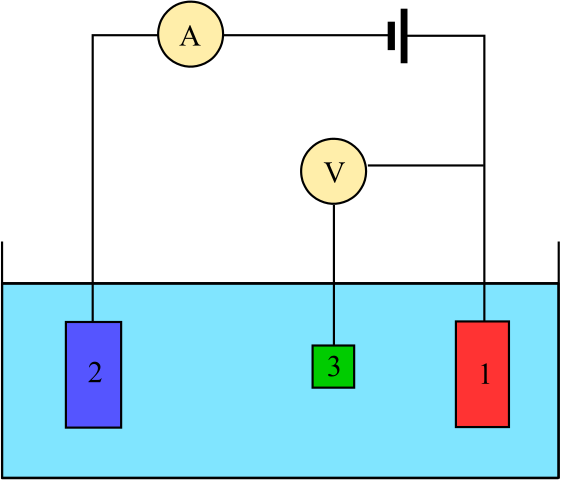 Diagramme pour une cellule électrochimique composée de trois électrodes: la référence (3), l'assistant (2) et l'œuvre (1). Source: Adam Rędzikowski, CC BY-SA 3.0, via Wikimedia Commons
Diagramme pour une cellule électrochimique composée de trois électrodes: la référence (3), l'assistant (2) et l'œuvre (1). Source: Adam Rędzikowski, CC BY-SA 3.0, via Wikimedia Commons Nous avons un diagramme pour une cellule avec trois électrodes, qui est couramment utilisée dans les analyses coulombimétriques. La réaction redox se déroule parmi les électrodes de travail (1) et auxiliaire (2). Parmi eux deux sont connectés la batterie, pour appliquer les potentiels sur la cellule, et l'amètre (a), pour mesurer les courants électriques.
Cependant, une électrode de référence (3) est nécessaire pour être en mesure de surveiller le potentiel de l'électrode de travail et de connaître ainsi la variation du potentiel d'électrode auxiliaire. De cette façon, le potentiel de toute la cellule peut être déterminé, etcellule, nécessaire pour estimer la fin des réactions redox dans l'un des types de coulombimétrie.
Notez qu'entre l'électrode de travail et l'électrode de référence ne fait presque pas de courant en raison du voltmètre à haute impédance (V), grâce à laquelle il y a une lecture du potentiel d'électrode de travail. Entre ces deux électrodes, nous avons un système similaire à celui d'une analyse potentiométrique: il est statique et non dynamique.
Il peut vous servir: chimie nucléaire: histoire, domaine d'étude, zones, applicationsPotentiel
La coulombimétrie est, pour ainsi dire, une électrolyse réalisée à des fins analytiques et quantitatives. Par conséquent, il est question d'appliquer des potentiels externes, fournis par une batterie, pour effectuer des réactions électrochimiques non spontanées; c'est-à-dire ceux qui ont des potentiels négatifs.
Considérez, par exemple, les réactions suivantes accompagnées de leurs normes potentielles respectives:
Cu2+ + 2E- ⇌ Cu (s) eºgrille = +0.337 V
H2Ou ⇌ 1/2O2(g) + 2h+ + 2E- Eºgrille = +1.230 V
Étant l'équation de la réaction globale égale à:
Cu2+ + H2Ou ⇌ cu (s) + 1/2o2(g) + 2h+ Eºgrille = -0.893 V
La batterie doit appliquer un potentiel de 0.893 V de sorte que l'électrode en cuivre et la formation d'ions hydrogène sont possibles. Ce potentiel est le ecellule. Cependant, dans la pratique, un potentiel supérieur à celui calculé doit être appliqué, car il existe des potentiels qui s'opposent à l'évolution de la réaction:
ETcellule = Ecathode - ETanode - Op - ir - cp
Où,
OP: surploitant (barrière cinétique)
IR: Ohmic (potentiel intrinsèque aux cellules)
CP: polarisation des concentrations (produit des diminutions de Cu2+)
Types de coulombimétrie
Il existe trois types de coulombimétrie: ampérostatique, potentiostatique et électromalimétrique.
Ampérostatique ou galvanostatique
Dans ce type de coulombimétrie, le courant qui traverse la cellule est constant en utilisant un ampérostate. Par conséquent, avoir le courant Toi Merci à la lecture de l'amètre, et aussi à connaître l'heure t Une fois l'électrolyse se terminer, nous pouvons calculer la charge associée à la transformation de l'analyte:
Q = Article
Une conséquence de maintenir le courant constant est que le changement potentiel des électrodes, soit positivement ou négative. Cette variation soudaine indique que l'analyte a complètement réagi, c'est-à-dire lorsque l'électrolyse s'arrête et est mesurée t. C'est la base des degrés coulométriques.
Si le potentiel se poursuit ou le téléchargement, d'autres espèces électroactives indésirables finiront par réagir. C'est pourquoi les potentiels associés aux transformations d'intérêt devraient être parfaitement connus.
Potentiostatique
Une façon d'empêcher d'autres espèces. C'est ici où la coulombimétrie potentidiotique entre, car il utilise un potentioste pour définir un certain potentiel pour la cellule. Contrairement à la coulombimetry ampérostatique, c'est maintenant le courant qui change au fil du temps.
Peut vous servir: toluène: structure, propriétés, utilisations, obtentionEn raison de cette configuration technique, nous ne pouvons pas calculer cela directement avec les valeurs de Toi et t; Le courant diminue avec le temps. En effet, à mesure que l'analyte réagit, il y aura de moins en moins de molécules ou d'atomes qui donnent ou accepteront les électrons. Par conséquent, qui est égal à une zone intégrale sous la courbe graphique Toi contre t.
Électrographie
La coulombimétrie électrographique, simplement connue sous le nom d'électrogravimétrie, est une électrolyse dans laquelle il n'est pas nécessaire pour mesurer les charges ou les courants électriques. Au lieu de cela, les masses des électrodes sont mesurées avant et après l'électrolyse.
Cette technique ne s'applique que lorsque les espèces réduites sont des cations métalliques qui sont des électrodes sur les électrodes, ce qui les rend plus lourds.
Applications
Potentiostique
Les analyses potentiostiques permettent de réduire ou d'oxyder sélectivement une espèce à la fois au milieu d'un mélange. Par exemple, ils sont utilisés pour déterminer la concentration des ions inorganiques suivants en quantités de traces ou dans des matrices complexes:
-Cu2+
-As3+
-CD2+
-Co2+
-Foi2+ et la foi3+
-PB2+
-X (f-, CL-, BR- et moi-)
-Ni2+
-Puan3+
-Agir+
-Sn2+
-Zn2+
-OU6+
De plus, ces analyses peuvent être utilisées pour déterminer la composition d'un alliage. Une fois l'alliage acide dissous, les potentiels cellulaires sont appliqués de manière échelonnée et contrôlée, déterminant ainsi la quantité réduite pour chaque cation métallique qui l'intégre.
Degrés coulométriques
Dans les degrés coulométriques, des agents médiateurs sont utilisés qui s'assurent de neutraliser ou de réagir complètement avec l'analyte restant. Le but de cela est d'empêcher les variations potentielles, à un courant constant, dériver dans les réactions collatérales. Ainsi, c'est un support possible, par exemple, de l'acide ascorbique en utilisant de l'iode comme médiateur.
Certains cations métalliques, comme AG+, CE3+, Foi3+, MN2+, Toi3+, Croisement2+, Ils peuvent également être déterminés par ces diplômes.
D'un autre côté, les réactions acides peuvent toujours utiliser cette technique, car de grands potentiels font que l'eau est ionique3SOIT+ ou oh-, qui servent à partir d'agents de titre générés in situ; c'est-à-dire qu'ils neutraliseront les acides ou les bases présentes.
Le CO2 de l'océan, les réactions de précipitations et la formation de complexes avec l'EDTA, sont également possibles pour les analyser en appliquant des degrés coulométriques, où des indicateurs redox sont ajoutés pour mettre en évidence le point final d'électrolyse.
Les références
- Jour, r., & Underwood, un. (1986). Chimie analytique quantitative (Fifth Ed.). Pearson Prentice Hall.
- Skoog d.POUR., Ouest D.M. (1986). L'analyse instrumentale. (Deuxième Ed.). Inter-américain., Mexique.
- Docteur. Doug Stewart. (2020). Définition de la coulométrie. Récupéré de: Chemicool.com
- Wikipédia. (2020). Coulométrie. Récupéré de: dans.Wikipédia.org
- Harvey David. (5 juin 2019). Méthodes coulométriques. CHIMISTER BOOLISTexts. Récupéré de: Chem.Bibliothèque.org
- « Cadre méthodologique comment l'écrire, structure, exemples
- Origine de philosophie contemporaine, caractéristiques, courants, auteurs »

