Configuration électronique externe
- 2765
- 799
- Louna Baron
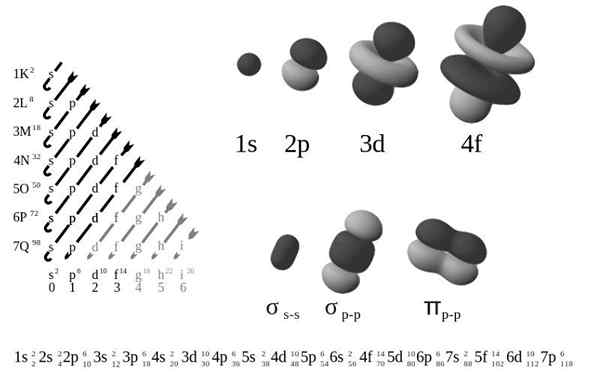
 Orbitales électroniques. Source: Patricia.Fidi, Wikimedia Commons
Orbitales électroniques. Source: Patricia.Fidi, Wikimedia Commons Qu'est-ce que la configuration électronique externe?
La Configuration électronique externe, Également appelé structure électronique, c'est la disposition des électrons à des niveaux et des sous-niveaux d'énergie autour d'un noyau atomique. Les niveaux sont de 1 à 7, et les sous-niveaux sont S, P, D et F.
Selon l'ancien modèle atomique de Bohr, les électrons occupent plusieurs niveaux en orbites autour du noyau, de la première couche la plus proche du noyau, k, à la septième couche, Q, la plus éloignée.
En termes de modèle mécanique quantique plus raffiné, les couches K-Q sont subdivisées en un ensemble d'orbitales, dont chacune ne peut être occupée par plus de quelques électrons.
Généralement, la configuration électronique est utilisée pour décrire les orbitales d'un atome dans son état fondamental, mais il peut également être utilisé pour représenter un atome qui a été ionisé dans un cation ou un anion, compensant la perte ou le gain d'électrons dans leurs orbitales respectives.
De nombreuses propriétés physiques et chimiques des éléments peuvent être corrélées avec leurs configurations électroniques uniques. Les électrons de Valencia, électrons dans la couche la plus externe, sont le facteur déterminant de la chimie unique de l'élément.
Concepts de base des configurations électroniques
Avant d'attribuer les électrons d'un atome aux orbitales, il faut se familiariser avec les concepts de base des configurations électroniques. Chaque élément du tableau périodique se compose d'atomes, qui sont composés de protons, de neutrons et d'électrons.
Les électrons présentent une charge négative et sont autour du noyau de l'atome dans les orbitales électron.
Les quatre différents types d'orbitales (S, P, D et F) ont des manières différentes, et une orbitale peut contenir un maximum de deux électrons. Les orbitales P, D et F ont des sous-niveaux différents, ils peuvent donc contenir plus d'électrons.
Peut vous servir: réacteur par lots: caractéristiques, pièces, applicationsComme indiqué, la configuration électronique de chaque élément est unique pour sa position dans le tableau périodique. Le niveau d'énergie est déterminé par la période, et le nombre d'électrons est donné par le nombre atomique de l'élément.
Les orbitales à différents niveaux d'énergie sont similaires, mais occupent différentes zones dans l'espace.
L'orbital 1s et les 2 orbitaux ont les caractéristiques d'un S orbital (nœuds radio, probabilités de volume sphérique, ne peuvent contenir que deux électrons, etc.). Mais, comme à différents niveaux d'énergie, ils occupent différents espaces autour du noyau. Chaque orbitale peut être représentée par des blocs spécifiques dans le tableau périodique.
Le bloc S est la région des métaux alcalins, y compris l'hélium (groupes 1 et 2), le bloc D est La série de lantanides et d'actinides.
Principe AUFBAU
Aufbau vient du mot allemand Aufbauen, Que signifie "construire". En substance, lors de l'écriture de configurations d'électrons, nous construisons des orbitales électroniques alors que nous passons d'un atome à un autre.
Au moment où nous écrivons la configuration électronique d'un atome, nous remplirons les orbitales dans l'ordre croissant du numéro atomique.
Le principe d'Aufbau provient du principe d'exclusion de Pauli, qui dit qu'il n'y a pas deux fermions (par exemple, les électrons) dans un atome. Ils peuvent avoir le même ensemble de nombres quantiques, ils doivent donc "s'accumuler" à des niveaux d'énergie plus élevés.
La façon dont les électrons s'accumulent est un problème de configuration d'électrons.
Les atomes stables ont autant d'électrons que les protons dans le noyau. Les électrons se réunissent autour du noyau en orbitales quantiques, suivant quatre règles de base appelées principes aufbau.
Peut vous servir: chlorure de baryum (BACL2)1. Il n'y a pas deux électrons dans l'atome partagés par les quatre mêmes nombres quantiques N, L, M et S.
2. Les électrons occuperont d'abord les orbitales du niveau d'énergie le plus bas.
3. Les électrons rempliront toujours les orbitales avec le même numéro de spin. Lorsque les orbitales seront pleines, elle commencera.
4. Les électrons rempliront les orbitales pour la somme des nombres quantiques n et l. Les orbitales avec des valeurs égales (n + l) seront remplies d'abord avec des valeurs N inférieures.
Les deuxième et quatrième règles sont fondamentalement les mêmes. Un exemple de la règle quatre serait les orbitales 2p et 3s.
Une orbitale 2p est n = 2 et l = 2 et une orbitale 3s est n = 3 et l = 1. (N + l) = 4 dans les deux cas, mais l'orbital 2p a la plus faible énergie ou la valeur inférieure et sera rempli avant la couche 3.
Heureusement, vous pouvez utiliser le diagramme Moeller illustré pour remplir les électrons. Le graphique est lu en exécutant les diagonales de 1.
 Diagramme Moeller. Source: Gabriel Bolívar
Diagramme Moeller. Source: Gabriel Bolívar Maintenant qu'il est connu que l'ordre des orbitales est rempli, la seule chose qui reste est de mémoriser la taille de chaque orbitale.
Les orbitales ont 1 valeur possible de ml Contenir 2 électrons
Les orbitales P ont 3 valeurs possibles de ml Contenir 6 électrons
Les orbitales ont 5 valeurs possibles de ml Contenir 10 électrons
F Les orbitales ont 7 valeurs possiblesl Contenir 14 électrons
C'est tout ce qui est nécessaire pour déterminer la configuration électronique d'un atome stable d'un élément.
Par exemple, prenez l'élément d'azote. L'azote a sept protons et, par conséquent, sept électrons. La première orbitale à remplir est l'orbital 1.
Une orbitale S a deux électrons, il reste donc cinq électrons. L'orbitale suivant est l'orbitale 2S et contient les deux suivants. Les trois derniers électrons iront à l'orbitale 2p qui peut contenir jusqu'à six électrons.
Peut vous servir: carboxyméthylcelluloseImportance de la configuration électronique externe
Les configurations d'électrons jouent un rôle important dans la détermination des propriétés de l'atome.
Tous les atomes du même groupe ont la même configuration électronique externe à l'exception du nombre atomique n, c'est pourquoi ils ont des propriétés chimiques similaires.
Certains des facteurs clés qui influencent les propriétés atomiques comprennent la taille des orbitales les plus importantes, l'énergie des orbitales la plus énergétiques, le nombre de postes vacants et le nombre d'électrons dans les orbitales d'une plus grande énergie.
La plupart des propriétés atomiques peuvent être liées au degré d'attraction entre les électrons externes au noyau et au nombre d'électrons dans la couche d'électrons les plus externes, le nombre d'électrons de valence.
Les électrons de la couche externe sont ceux qui peuvent former des liaisons chimiques covalentes, qui ont la capacité de former des cations ou des anions et ceux qui donnent l'état d'oxydation aux éléments chimiques.
Ils détermineront également le rayon atomique. À mesure que n devient plus grand, le rayon atomique augmente. Lorsqu'un atome perd un électron, il y aura une contraction du rayon atomique en raison de la diminution de la charge négative autour du noyau.
Les électrons de la couche externe sont pris en compte par la théorie de la liaison de Valencia, la théorie du champ cristallin et la théorie orbitale moléculaire pour obtenir les propriétés des molécules et les hybridations des liaisons.
Les références
- Aufbau Main. Chem récupéré.Bibliothèque.org.
- Bozeman Science. Configuration d'électrons. Récupéré de YouTube.com.
- Configurations électroniques et propriétés des atomes. Récupéré de Oneonta.Édu.

