Structure de chlorure ferreux (FECL2), utilisations, propriétés

- 3487
- 778
- Lucas Schneider
Il chlorure ferreux C'est un solide inorganique formé par l'union d'un cation foi2+ et deux anions chlorure cl-. Sa formule chimique est fecl2. Il a tendance à absorber l'eau de l'environnement. L'un de ses hydrates est FECL Tetrahydrate2 •4h2Ou qui est un solide verdâtre.
Soulignent qu'il est très soluble dans l'eau et a tendance à s'oxyder facilement en présence d'air formant le chlorure de fecl ferrique3. Pour être facilement oxydable et donc capable d'agir comme réducteur est largement utilisé dans les laboratoires de recherche chimique et biologique.
 Ferroso Tetrahydrate chlorure fecl2 •4h2Ou solide. Craven [cc by-sa 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]. Source: Wikimedia Commons.
Ferroso Tetrahydrate chlorure fecl2 •4h2Ou solide. Craven [cc by-sa 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]. Source: Wikimedia Commons. Le chlorure ferreux a plusieurs utilisations parmi lesquelles pour aider d'autres agents dans l'oxydation des boues dérivées des eaux usées ou des eaux usées. Il est également utilisé dans le processus de revêtement en fer métal et a quelques utilisations dans l'industrie pharmaceutique.
L'utilisation FECL a également été expérimentée2 Dans la récupération de métaux précieux des catalyseurs usés trouvés dans les tuyaux d'échappement des véhicules qui fonctionnent avec de l'essence ou du diesel.
Il est utilisé dans l'industrie textile pour fixer les couleurs dans certains types de tissu.
[TOC]
Structure
Le chlorure ferreux est formé par un ion ferreux2+ et deux ions chlorure cl- United via des liens ioniques.
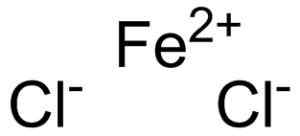 Ferroso Chloro Fecl2 où sont les ions qui se marient. EPOP [domaine public]. Source: Wikimedia Commons.
Ferroso Chloro Fecl2 où sont les ions qui se marient. EPOP [domaine public]. Source: Wikimedia Commons. La foi ferreuse2+ Il a la structure électronique suivante:
12, 2s2 2 P6, 3s2 3p6 3D6, 4s0
où vous pouvez voir que vous avez perdu deux électrons de la couche 4s.
Cette configuration n'est pas très stable, et pour cette raison, elle a tendance à s'oxyder, c'est-à-dire perdre un autre électron, cette époque de la couche 3D, formant l'ion de foi3+.
Pour sa part, le chlorure d'ions CL- Il a la structure électronique suivante:
12, 2s2 2 P6, 3s2 3p6
où vous pouvez voir que vous avez acquis un électron supplémentaire dans la couche 3p, en le complétant. Cette configuration est très stable car toutes les couches électroniques sont complètes.
Nomenclature
- Chlorure ferreux
- Chlorure de fer (II)
Il peut vous servir: détermination des cendres: méthodes et exemples- Dichlorure de fer
- Chlorure ferreux tétrahydraté: fecl2 •4h2SOIT
Propriétés
État physique
Colorful à vert pâle, cristaux.
Poids moléculaire
126,75 g / mol
Point de fusion
674 ºC
Point d'ébullition
1023 ºC
Poids spécifique
3,16 à 25 ºC / 4 ºC
Solubilité
Très soluble dans l'eau: 62,5 g / 100 ml à 20 ºC. Soluble dans l'alcool, acétone. Légèrement soluble dans le benzène. Pratiquement insoluble dans l'éther.
Autres propriétés
Le fecl2 anhydre est très hygroscopique. Absorber l'eau avec facilité de l'environnement, formant une variété d'hydrates, en particulier le tétrahydrate, dans lequel pour chaque molécule FECL2 Il y a 4 molécules H2Ou lié à cela (FECL2 •4h2SOIT).
En présence d'air, il s'oxyde lentement à FECL3. Cela signifie que l'ion de foi2+ Oxyde facilement la foi ion3+.
Si vous chauffez en présence de chlorure ferrique à air rapide FECL3 Et l'oxyde ferrique Fe2SOIT3.
Le fecl2 Il est corrosif pour les métaux et les tissus.
Obtention
Il est obtenu en traitant un excès de foi de fer avec une solution aqueuse d'acide chlorhydrique HCL à des températures élevées.
Foi0 + 2 HCl → FECL2 + 2 h+
Cependant, en raison de la présence d'eau à travers cette méthode, le chlorure de tétrahydrate ferreux est obtenu2 •4h2SOIT.
Pour obtenir l'anhydre (sans eau incorporée dans les cristaux), certains chercheurs ont choisi d'effectuer la réaction de la poussière de fer avec des collines anhydre (sans eau) dans le solvant de tétrahydrofuran (THF) à une température de 5 ° C.
Le composé FECL est obtenu de cette manière2 •1.5thf, qui lorsqu'il est chauffé à 80-85 ºC dans le vide ou dans l'atmosphère d'azote (pour éviter la présence d'eau) produit le FECL2 anhydre.
Applications
Le chlorure ferreux a diverses utilisations en fonction de sa capacité de réduction, c'est-à-dire qu'elle peut être facilement oxydée. Il est utilisé par exemple dans les peintures et les revêtements, car il aide à les réparer de la surface.
Le fer est un micronutriment essentiel pour la santé humaine et certains animaux. Il est impliqué dans la synthèse des protéines, la respiration et la multiplication des cellules.
Par conséquent le FECL2 Il est utilisé dans les préparations pharmaceutiques. La foi ion2+ En tant que tel, il est mieux absorbé que l'ion de foi3+ Dans l'intestin.
Peut vous servir: carbonate de calcium: structure, propriétés, formation, utilisationsIl est utilisé pour la fabrication FECL3. Il est utilisé en métallurgie, dans des revêtements de fer, pour fournir un dépôt plus ductile.
Voici d'autres utilisations importantes.
En coloration en tissu
Le fecl2 Il est utilisé comme un fixateur mordant ou colorant dans certains types de tissu. Le mordant réagit chimiquement et se joint simultanément au colorant et le tissu formant un composé insoluble sur ce.
De cette façon, le colorant est fixé au tissu et sa couleur s'intensifie.
 Chlorure ferreux fecl2 Permet de fixer les couleurs sur des tissus. Gina Pina [CC par 2.0 (https: // CreativeCommons.Org / licences / par / 2.0)]. Source: Wikimedia Commons.
Chlorure ferreux fecl2 Permet de fixer les couleurs sur des tissus. Gina Pina [CC par 2.0 (https: // CreativeCommons.Org / licences / par / 2.0)]. Source: Wikimedia Commons. Dans le traitement des eaux usées
Le fecl2 Il est utilisé dans les usines de traitement des eaux usées ou des déchets (eaux d'égout).
Dans cette application, le chlorure ferreux participe à l'oxydation de la boue, à travers un processus appelé Fenton Oxydation. Cette oxydation provoque la rupture des flocles de boue et permet la libération d'eau fortement attachée à cela.
 Section d'une usine de traitement des eaux usées où vous pouvez voir la boue. Parfois, cela est traité avec du chlorure de ferroso fecl2 afin qu'il puisse être plus facilement séparé de l'eau. Evelyn Simak / Sewage Travaux au nord de Dickleburgh. Source: Wikimedia Commons.
Section d'une usine de traitement des eaux usées où vous pouvez voir la boue. Parfois, cela est traité avec du chlorure de ferroso fecl2 afin qu'il puisse être plus facilement séparé de l'eau. Evelyn Simak / Sewage Travaux au nord de Dickleburgh. Source: Wikimedia Commons. Ensuite, la boue peut sécher et jeter. L'utilisation du chlorure ferreux aide à réduire les coûts de processus.
Il a également été récemment proposé pour réduire la formation de sulfure de gaz ou de sulfure d'hydrogène dans lesdits égouts des égouts.
De cette façon, la corrosion produite par ce gaz et les odeurs désagréables seraient réduites.
En études chimiques
Pour ses propriétés réducteurs (l'opposé de l'oxydation) le fecl2 Il est largement utilisé dans diverses recherches dans les laboratoires de chimie, de physique et d'ingénierie.
Certains scientifiques ont utilisé une vapeur de chlorure ferreux.
Ces catalyseurs sont utilisés pour éliminer les gaz nocifs pour l'être humain et l'environnement. Ils sont situés dans le tube d'évasion des voitures et des camions qui fonctionnent avec de l'essence ou du diesel.
Peut vous servir: masse molaire: comment il est calculé, exemples et exercices résolus Tube d'échappement d'un véhicule où une section plus volumineuse est observée, c'est là que le catalyseur est situé pour convertir les gaz nocifs en gaz amicaux avec l'environnement. Ahanix1989 à l'anglais Wikipedia [domaine public]. Source: Wikimedia Commons.
Tube d'échappement d'un véhicule où une section plus volumineuse est observée, c'est là que le catalyseur est situé pour convertir les gaz nocifs en gaz amicaux avec l'environnement. Ahanix1989 à l'anglais Wikipedia [domaine public]. Source: Wikimedia Commons. Après un certain temps, le catalyseur du véhicule est dépensé et perd de l'efficacité et vous devez le remplacer. Le catalyseur usé est jeté et des efforts sont faits pour récupérer les métaux précieux qu'il contient.
 Grille en céramique du catalyseur où les traces de métaux précieuses pour récupérer avec FECL sont situés2. Recyclage du monde mondial [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]. Source: Wikimedia Commons.
Grille en céramique du catalyseur où les traces de métaux précieuses pour récupérer avec FECL sont situés2. Recyclage du monde mondial [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]. Source: Wikimedia Commons. Selon les chercheurs, avec le fer du chlorure ferreux, ces métaux ont formé des alliages magnétiques.
Les alliages peuvent être extraits avec des aimants puis récupéré les métaux précieux par des méthodes déjà connues.
En études biochimiques
Pour posséder le cation foi2+, qui est un micronutriment important dans l'être humain et certains animaux, le fecl2 Il est utilisé dans les études de biochimie et de médecine.
Certaines études ont été autorisées à démontrer que le chlorure ferreux améliore l'efficacité fongicide du plasma froid de l'argon.
Le plasma froid est une technologie utilisée pour la stérilisation des surfaces médicales et des instruments. Il est basé sur la formation de radicaux hydroxyles oh · de l'humidité de l'environnement. Ces radicaux réagissent avec la paroi cellulaire du micro-organisme et provoquent leur mort.
Dans cette enquête, la FECL2 L'effet du plasma froid s'est amélioré et a accéléré l'élimination d'un champignon résistant aux autres méthodes de désinfection.
Certains scientifiques ont constaté que l'utilisation de FECL2 Il permet d'augmenter les performances du glucose à obtenir des réactions basées sur la bagasse de canne à sucre.
Dans ce cas, être la foi2+ Un microacment essentiel pour la santé humaine, sa présence dans les traces du produit n'affecterait pas l'être humain.
Les références
- Fukuda, s. et al. (2019). Le chlorure ferreux et le sulfate ferreux améliorent l'efficacité fongicide du plasma d'argon atmosphérique froid sur les pullulans auréobasidium mélanisés. J Biosci Bioeng, 2019, 128 (1): 28-32. NCBI a récupéré.Clm.NIH.Gouvernement.
- Ismal, ou.ET. et yildirim, l. (2019). Gags en métal et biomordants. Dans l'impact et les perspectives de la chimie verte pour la technologie textile. Chapitre 3, pp.57-82. Récupéré de ScienceDirect.com.
- Zhang, W. et al. (2019). Co-cathalyse du chlorure de magnésium et du chlorure ferreux pour les xylo-oligosaccharides et la production de glucose à partir de la bagasse de canne à sucre. Bioresoral Technol 2019, 291: 121839. NCBI a récupéré.NLM.NIH.Gouvernement.
- Zhou, x. et al. (2015). Rôle du fer indigène dans l'amélioration de la désharbacs des boues cette peroxydation. Rapports scientifiques 5: 7516. NCBI a récupéré.NLM.NIH.Gouvernement.
- Rathnayake, D. et al. (2019). Contrôle de sulfure d'hydrogène dans les égouts en catalysant la réaction avec l'oxygène. Science de l'environnement total 689 (2019) 1192-1200. NCBI a récupéré.NLM.NIH.Gouvernement.
- Taninouchi, et. Et Okabe, t.H. (2018). Récupération des métaux du groupe Platinum à partir de catalyseurs usées utilisant un traitement de vapeur de chlorure de fer. Metall et Materi Trans B (2018) 49: 1781. Lien récupéré.Springer.com.
- OU.S. Bibliothèque nationale de médecine. (2019). Chlorure ferreux. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement.
- Aresta, m. et al. (1977). Fer (0) oxydation par chlorure d'hydrogène dans le tétrahydrofurane: voie simple vers le chlorure de fer anhydre (II). Chimie inorganique, vol. 16, non. 7, 1977. Récupéré des pubs.ACS.org.
- Coton, F. Albert et Wilkinson, Geoffrey. (1980). Chimie inorganique avancée. Quatrième édition. John Wiley & Sons.
- « Historique et signification du drapeau du Portugal (images révisées)
- Origine d'éthique chrétienne, fondamentaux, représentants »

