Chlorure d'étain (II)
- 3907
- 681
- Adam Mercier
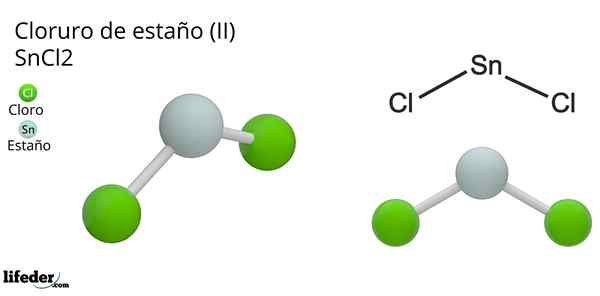
Il Chlorure d'étain (Ii) ou un minuscule chlorure de la formule chimique sncl2, Il s'agit d'un composé solide blanc et cristallin, produit de la réaction en étain et une solution d'acide chlorhydrique concentrée: Sn (s) + 2HCl (Conc) => SNC2(aq) + h2(g). Le processus de sa synthèse (préparation) consiste à ajouter des morceaux d'étain pour réagir avec l'acide.
Après avoir ajouté les morceaux d'étain, la déshydratation et la cristallisation sont effectuées jusqu'à ce que le sel inorganique soit obtenu. Dans ce composé, la boîte a perdu deux électrons de sa couche de valence pour former des liens avec les atomes de chlore.
Cela peut être mieux compris si la configuration d'étain Valencia est prise en compte (5S25 PX2pet0pz0), dont la paire d'électrons occupant l'orbital pX est affecté aux protons h+, Afin de former une molécule d'hydrogène diatomique. C'est-à-dire, c'est une réaction de type redox.
[TOC]
Propriétés du chlorure d'étain
 Chlorure d'étain (ii) dihydrate
Chlorure d'étain (ii) dihydrate Liens SNCL2 Ils sont de type ionique ou covalent? Les propriétés physiques du chlorure d'étain (II) jettent la première option. Les points de fusion et d'ébullition pour ce composé sont de 247 ºC et 623 ºC, indicatifs de faibles interactions intermoléculaires, fait commun pour les composés covalents.
Ses cristaux sont blancs, ce qui se traduit par une absorption nulle dans le spectre visible.
Configuration de Valence
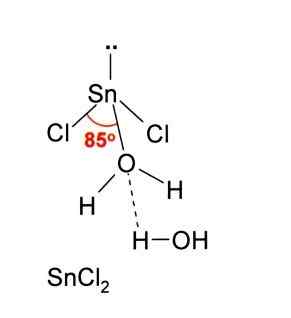
Dans l'image ci-dessus, une menthe isolée de Snick est illustrée2.
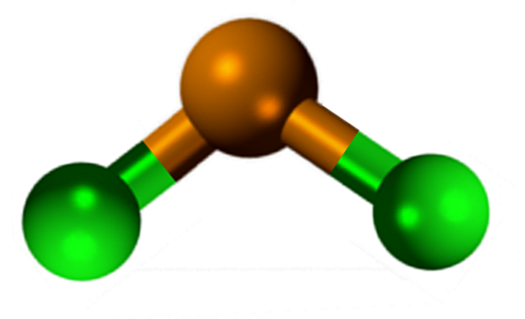
La géométrie moléculaire doit être plate car l'hybridation de l'atome central est SP2 (3 orbitales sp2 et une orbitale p pure pour former des liaisons covalentes), mais le couple sans électrons occupe le volume et pousse les atomes de chlore vers le bas, donnant à la molécule une géométrie angulaire.
En phase gazeuse, ce composé est isolé, donc il n'interagit pas avec les autres molécules.
Peut vous servir: saponificationComme perte de la paire d'électrons dans l'orbital pX, L'étain se transforme en sn ion2+ et sa configuration électronique résultante est 5S25 PX0pet0pz0, Avec toutes ses orbitales disponibles pour accepter les liens d'autres espèces.
Clôture- Ils se coordonnent avec l'ion sn2+ Pour donner naissance au chlorure d'étain. La configuration électronique de l'étain dans ce sel est 5S25 PX2pet2pz0, Pouvoir accepter une autre paire d'électrons dans votre orbital librez.
Par exemple, vous pouvez accepter un autre ion CL-, formant le complexe de géométrie plate trigonale (une pyramide de base triangulaire) et chargé négativement [sncl3]]-.
Réactivité
Le sncl2 Il a une réactivité élevée et une tendance à se comporter comme l'acide Lewis (récepteur d'électrons) pour compléter son octet de valence.
Ainsi que accepter un ion cl-, Il en va de même pour l'eau, qui "hydrate" l'atome d'étain lorsqu'une molécule d'eau est liée directement à l'étain, et une deuxième molécule d'eau forme des interactions par des ponts d'hydrogène avec le premier.
Le résultat est que le sncl2 Il n'est pas pur, mais coordonné avec l'eau dans son sel dihydraté: sncl2· 2h2SOIT.
Le sncl2 Il est très soluble dans les solvants d'eau et polaires, car c'est un composé polaire. Cependant, sa solubilité dans l'eau, moins que son poids de masse, active une réaction d'hydrolyse (rupture d'une molécule d'eau) pour générer un sel de base et insoluble:
Sncl2(aq) + h2Ou (l) sn (oh) cl (s) + hcl (aq)
La double flèche indique qu'un équilibre est établi, favorisé à gauche (vers les réactifs) si les concentrations de HCl augmentent. Par conséquent, SNCL Solutions2 Les employés ont un pH acide, pour éviter les précipitations du produit de sel indésirable de l'hydrolyse.
Il peut vous servir: nucléophile: attaque nucléophile, types, exemples, nucléophilicitéActivité réductrice
Réagit avec l'oxygène de l'air pour former du chlorure d'étain (IV) ou du chlorure est:
6 sncl2(aq) + o2(g) + 2h2Ou (l) => 2Sncl4(aq) + 4sn (oh) cl (s)
Dans cette réaction, l'étain oxyde le lien de formation avec l'atome d'oxygène électronégatif et augmente son nombre de liaisons avec les atomes de chlore.
En général, les atomes électronégatifs des halogènes (F, Cl, Br et I) stabilisent les liens des composés Sn (IV) et ce fait explique pourquoi le sncl2 est un agent réducteur.
Lorsqu'il est oxydé et perd tous ses électrons de valence, le sn ion4+ CONFIGURATION 5S05 PX0pet0pz0, Étant la paire d'électrons dans l'orbitale 5S, le plus difficile à "emporter".
Structure chimique du chlorure d'étain
 Structure du chlorure d'étain (II)
Structure du chlorure d'étain (II) Le sncl2 Il présente une structure cristalline de type ortorrombique, similaire aux rangées de serruchos, dans lesquelles les pointes des dents sont des chlorures.
Chaque ligne est une chaîne SNCL3 formant un pont CL avec un autre atome SN (CL-SN (CL)2-Cl- ···). Deux chaînes, ainsi que des interactions faibles du type SN-CL constituent une couche de la disposition, qui chevauche sur une autre couche, et ainsi de suite jusqu'à définir le solide cristallin.
La paire d'électrons gratuits 5s2 Provoquer une distorsion dans la structure car elle occupe le volume (le volume du nuage électronique).
Le SN peut avoir un nombre de coordination égal à neuf, ce qui est le même que d'avoir neuf voisins, en dessinant un prisme trigonal avec celui situé au centre de la figure géométrique et le CL dans les sommets, en plus d'autres CL situés dans chacun de les visages carrés du prisme.
Peut vous servir: hydraceCeci est plus facile à observer s'il est considéré comme une chaîne où le SN (sphères gris foncé) pointent vers le haut, et les trois CL sont liés à cette forme le plancher triangulaire, tandis que les trois clients forment le toit triangulaire supérieur.
Utilisations / applications
Dans la synthèse organique, il est utilisé comme agent réducteur des composés nitro aromatiques (AR-NO2 à ar-nh2). Comme sa structure chimique est laminaire, elle trouve une utilisation dans le monde de la catalyse des réactions organiques, en plus d'être un candidat potentiel pour le soutien catalytique.
Sa propriété réductrice est exploitée pour déterminer la présence de composés d'or, pour couvrir le verre avec des miroirs en argent et pour servir d'antioxydant.
Aussi, dans sa pyramide trigonal de géométrie moléculaire (: Snx3- M+) est utilisé comme base de Lewis pour la synthèse d'un grand nombre de composés (comme le complexe de cluster PT3Sn8CLvingt, où la paire sans électrons est coordonnée avec un acide Lewis).
Des risques
Le sncl2 Vous pouvez endommager les globules blancs. Il est corrosif, irritant, cancérigène et a des impacts négatifs élevés sur les espèces qui habitent les écosystèmes marins.
Peut se décomposer à des températures élevées, libérant le chlore gazeux nocif. En contact avec des agents très oxydants déclenchent des réactions explosives.
Les références
- Fhiver & Atkins. (2008). Chimie inorganique. Dans Les éléments du groupe 14 (quatrième édition., p. 329). Mc Graw Hill.
- Livre chimique. (2017). Chemicalbook: Chemicalbook.com
- Se publier. (2018). Chlorure d'étain. PubChem récupéré: PubChem.NCBI.NLM.NIH.Gouvernement
- Wikipédia. (2017). Tin (ii) chlorure. Wikipedia a récupéré: dans.Wikipédia.org
- F. Hulliger. (1976). Chimie structurelle des phases de type couche. P-120,121. D. Reidel Publishing Company.

