Structure chlorure de chrom (CRCL3), propriétés, utilisations

- 3819
- 695
- Adrien Remy
Il Chlorure chromé (CRCL3) C'est un sel inorganique composé de cations CR3+ et les anions CL- dans une proportion 1: 3; c'est-à-dire pour chaque cr3+ Il y a trois CL-. Comme on le verra plus tard, leurs interactions ne sont pas ioniques. Ce sel peut se produire sous deux formes: l'anhydra et l'hexahydrate.
La forme anhydre est caractérisée par la présentation d'une coloration violet-rougeh; Alors que l'hexahydrate, crcl3.6h2Ou, c'est vert foncé. L'incorporation de molécules d'eau modifie les propriétés physiques de ces cristaux; comme ses points d'ébullition et de fusion, de densités, etc.
 Cristaux violet-river de chlorure chromé (iii) anhydre. Source: Ben Mills [domaine public]
Cristaux violet-river de chlorure chromé (iii) anhydre. Source: Ben Mills [domaine public] Le chlorure de chrome (III) (selon la nomenclature des stocks) se décompose à des températures élevées, devenant chlorure de chrome (II), CRCL2. Il est corrosif pour les métaux, bien qu'il soit utilisé dans le chrome: procédure dans laquelle les métaux sont recouverts d'une fine couche de chrome.
Le CR3+, Venant de son chlorure respectif, il a été utilisé dans le traitement du diabète, en particulier chez les patients atteints de nutrition parentérale totale (TPN), qui n'ingénère pas la quantité de chromée requise. Cependant, les résultats sont bien meilleurs (et plus fiables) s'ils sont fournis comme picolinato.
[TOC]
Structure de chlorure de chrome
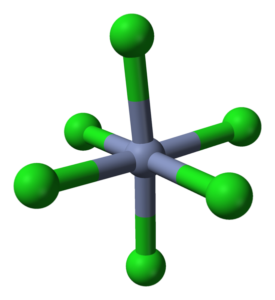 Coordination octaedro pour CRCL3 dans ses cristaux. Source: Ben Mills [domaine public]
Coordination octaedro pour CRCL3 dans ses cristaux. Source: Ben Mills [domaine public] Le crcl3 En dépit d'être un sel, la nature de leurs interactions n'est pas purement ionique; Ils ont un certain caractère covalent, le produit de la coordination entre Cr3+ et cl-, qui donnent naissance à un octaèdre déformé (image supérieure). Le chrome est situé au centre de l'Octaedro et les chloros à ses sommets.
L'octaèdre CRCL6 Vous pouvez, à première vue, contredire la formule CRCL3; Cependant, cet octaèdre complet ne définit pas la cellule unitaire du verre, mais un cube (également déformé), qui coupe les sphères vertes ou les anions chlore.
Peut vous servir: 20 exemples de sublimation chimique et de caractéristiquesCouches cristallines d'anhydre
Ainsi, la cellule unitaire avec cet octaedro continue de maintenir la proportion 1: 3. Reproduisant ces cubes déformés dans l'espace, le cristal CRCL est obtenu3, qui est représenté dans l'image supérieure avec un modèle de remplissage à trois dimensions et un modèle de sphères et de barres.
 Couche de structure cristalline CRCL3 représentée avec un modèle de sphères et de barres à trois dimensions. Source: Ben Mills [domaine public]
Couche de structure cristalline CRCL3 représentée avec un modèle de sphères et de barres à trois dimensions. Source: Ben Mills [domaine public] Cette couche cristalline est l'une des nombreuses qui font3 (Ne confondez pas la couleur du verre, vrai, avec celle des sphères vertes).
Comme on peut le voir, les anions CL- Ils occupent la surface, donc leurs charges négatives repoussent les autres couches cristallines. Par conséquent, les cristaux deviennent des escroqueries et fragiles; Mais brillant, à cause du chrome.
Si ces mêmes couches sont visualisées dans une perspective latérale, il sera observé, au lieu d'Octaèdre, des tétraèdeurs déformés:
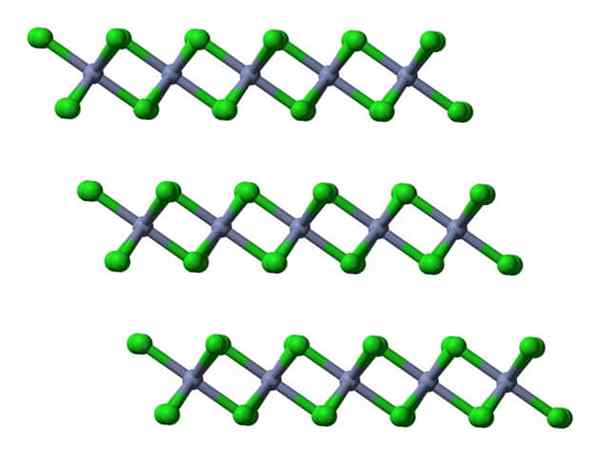 CRCL3 Couches cristallines vues latéralement. Source: Ben Mills.
CRCL3 Couches cristallines vues latéralement. Source: Ben Mills. Ici, la compréhension des raisons pour lesquelles les couches sont repoussées les unes avec les autres sont facilitées lorsque le CL- de ses surfaces.
Propriétés
Des noms
-Chlorure de chrome (III)
-Trichlorure chromé (III)
-Chlorure chromé (iii) anhydre.
Formule chimique
-CRCL3 (anhydre).
-CRCL3.6h2O (hexahing).
Poids moléculaire
-158,36 g / mol (anhydre).
-266,43 g / mol (hexahydrate).
Description physique
-Cristaux solides et violet-redistic (anhydre).
-Du poussière cristalline du vert foncé (hexahydrate, image inférieure). Dans cet hydrate, il peut être vu comme l'eau inhibe la luminosité, la caractéristique du chrome métallique.
 Hexahydrate chrome chrome. Source: utilisateur: Walkerma [domaine public]
Hexahydrate chrome chrome. Source: utilisateur: Walkerma [domaine public] Point de fusion
-1.152 ºC (2.106 ºF, 1.425 K) (anhydrum)
-83 ºC (hexahydrate).
Point d'ébullition
1300 ºC (2.370 ºF, 1.570) (anhydrum).
Solubilité dans l'eau
 Solutions aqueuses de chlorure de chrome (III). Source: Leiem [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)]
Solutions aqueuses de chlorure de chrome (III). Source: Leiem [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)] -Légèrement soluble (anhydro).
-585 g / L (hexahydrate).
Dans l'image supérieure, une série de tubes à essai remplis d'une solution aqueuse de CRCL est montré3. Notez que plus il est concentré, plus la couleur du complexe est intense [CR (OH2)6]]3+, Couleur verte responsable.
Peut vous servir: putrescina: structure, propriétés, synthèse, utilisationsSolubilité dans les solvants organiques
Soluble dans l'éthanol, mais insoluble dans l'éther (anhydre).
Densité
-2,87 gr / cm3 (anhydre).
-2,76 g / cm3 (Hexahydrate).
Température de stockage
Décomposition
Lorsqu'elle est chauffée à la décomposition, le chlorure de chrome (III) émet des fumées toxiques de composés contenant du chlore. Ces composés sont également libérés lorsque le chlorure de chrome (III) entre en contact avec des acides forts.
Corrosion
Il est hautement corrosif et peut attaquer certains aciers.
Réactions
Il est incompatible avec de forts oxydants. Il réagit également fortement avec le lithium et l'azote.
Lorsqu'il est chauffé en présence d'hydrogène, il est réduit au chlorure de chrome (II), avec la formation de chlorure d'hydrogène.
2 CRCL3 + H2 => 2 crcl2 + 2 HCl
pH
Dans une solution aqueuse et avec une concentration de 0,2 m: 2,4.
La synthèse
Le chlorure de chromé (III) est produit, réagissant à l'hydroxyde de chrome avec de l'acide chlorhydrique et de l'eau.
CR (OH)3 + 3 HCL +3 H2O => CRCL3.6h2SOIT
Ensuite, pour obtenir du sel d'anhydra, le crcl est chauffé3.6h2Ou en présence de chlorure de tionilo, SOCL2, acide chlorhydrique et chaleur:
[Cr (h2SOIT)6] Cl3 + 6socl2 + ∆ → CRCL3 + 12 HCL + 6SO2
Alternativement, le CRCL3 Le chlore gazeux est obtenu sur un mélange de chrome et d'oxyde de carbone.
Croisement2SOIT3 + 3 C + CL2 => 2 crcl3 + 3 CO
Et enfin, étant la méthode la plus utilisée, c'est pour chauffer son oxyde avec un agent halogénant, comme le tétrachlorure de carbone:
Croisement2SOIT3 + 3ccl4 + ∆ → 2crcl3 + 3COCL2
Applications
Industriels
Le chlorure de chrome intervient dans la préparation de chlorure de chromé (II); réactif qui intervient dans la réduction des halogénures d'alkyle et dans la synthèse des haluros de (e) -salquenilo.
Peut vous servir: oxalate de sodium (NA2C2O4): Structure, propriétés, utilisations, risques-Il est utilisé dans la technique chromée. Cela consiste à déposer, par la galvanoplastie, une belle couche de chrome sur des objets métalliques ou un autre matériau avec un objectif décoratif, augmentant ainsi la résistance à la corrosion et également la dureté de surface.
-Il est utilisé comme mordant textile, servant de lien entre le matériau de coloration et les tissus à teints. De plus, il est utilisé comme catalyseur pour la production d'oléfines et d'agents d'étanchéité.
Thérapeutique
L'utilisation d'un supplément de chlorure de chrome USP U USP est recommandée chez les patients qui ne reçoivent que des solutions intraveineuses, administrées pour la nutrition parentérale totale (TPN). Par conséquent, uniquement lorsque ces patients ne reçoivent pas toutes leurs besoins nutritionnels.
Le chrome (III) fait partie du facteur de tolérance au glucose, un activateur des réactions favorisées par l'insuline. On pense que le chrome (III) active le métabolisme du glucose, des protéines et des lipides, facilitant l'action de l'insuline chez l'homme et les animaux.
Le chrome est présent dans de nombreux aliments. Mais sa concentration ne dépasse pas 2 par ration, le brocoli étant la nourriture avec la plus grande contribution (11 µg). De plus, l'absorption intestinale du chrome est faible, avec une valeur de 0,4 à 2,5% de la quantité ingérée.
Cela rend difficile d'établir un régime pour l'alimentation chromée. En 1989, la National Academy of Sciences a recommandé entre 50 et 200 µg / jour comme un apport chromé adéquat.
Des risques
Parmi les risques possibles de la consommation de ce sel en tant que supplément de chrome, figurent:
-Douleurs à l'estomac.
-Des saignements anormaux, qui peuvent varier des difficultés pour guérir une blessure, des ecchymoses les plus riches ou l'assombrissement du produit de selles fécales de saignement interne.
-Irritations dans le système digestif, provoquant des ulcères ou des intestins d'estomac.
-Dermatite
Les références
- Fhiver & Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Wikipédia. (2019). Chlorure de chrome (III). Récupéré de: dans.Wikipédia.org
- Chlorure de chrome (III) [PDF]. Récupéré de: alpha.Chem.Ombragère.Édu
- Se publier. (2019). Chlorure de chrome hexahydrate. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement
- Institut national de la santé. (21 septembre 2018). Chrome: Fiche d'information sur les compléments alimentaires. Récupéré de: SDG.Dyerne.NIH.Gouvernement
- Tomlinson Carole a. (2019). Effets secondaires du chlorure de chrome. Leaf Group Ltd. Récupéré de: sain.com
- « Pourquoi est-il important de lire? 10 avantages de la lecture
- Historique de borax, structure, propriétés, utilisations, synthèse, risques »

