Chlorure de calcium (CACL2)
- 1556
- 212
- Paul Dumas
Nous expliquons quel chlorure de calcium, sa structure, ses propriétés physiques et chimiques, comment elle est synthétisée et ses applications
Qu'est-ce que le chlorure de calcium?
Il chlorure de calcium (Cacl2) C'est un sel inorganique composé de calcium, de métal alcalin et de chlore halogène. Dans ce composé, il existe plusieurs interactions électrostatiques qui définissent l'apparence externe de leurs cristaux et le reste de ses propriétés physiques.
Il s'accompagne également de molécules d'eau, formant des formules générales de COCL2· XH2Ou, avec x = 0, 1, 2, 4 et 6. Lorsque x = 0, le sel manque d'eau et est anhydride, comme indiqué par sa formule chimique mentionnée ci-dessus.
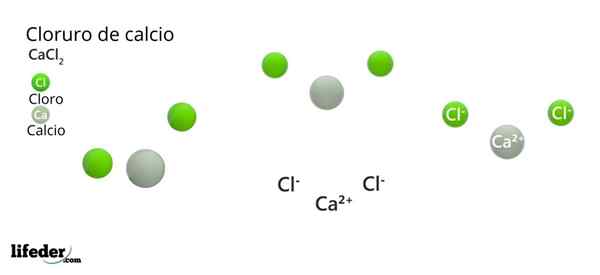
Dans l'image supérieure, certaines parties solides de CaCl sont illustrées2. Dans des conditions de peu d'humidité, c'est possible.
Formule
Sa formule chimique est CACL2: Exprime cela pour chaque CA ion2+ Il y a deux clôtures- qui neutralise la charge positive. Le groupe de calcium-de-groupe 2 du tableau périodique (SR. Scholambara) - donne ses deux électrons à chaque atome de chlore, élément du groupe 17.
Structure du chlorure de calcium
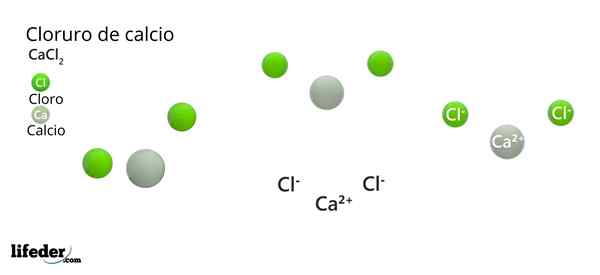
Dans l'image supérieure, la structure CACL est illustrée2 anhydride. Les sphères vertes correspondent aux ions CL-, tandis que blanc aux ions ca2+. Ces sphères sont fixées dans une parallélépipée, qui n'est rien de plus que la cellule ortorrombique unitaire des cristaux.
La structure peut donner la fausse idée que le calcium prédomine; Cependant, si davantage de répétitions de la cellule unitaire sont reproduites, la plus grande abondance des sphères vertes serait claire: les clôtures-.
D'un autre côté, des ions CA2+ Ils ont des radios ioniques plus petites que-. En effet, lorsqu'ils perdent des électrons, les noyaux des atomes exercent une plus grande force d'attraction sur les couches électroniques externes, ce qui réduit le rayon ionique.
Dans le cas du CL-, Cela a un électron supplémentaire qui ne peut pas être attiré par la même force, augmentant ainsi son rayon ionique.
Peut vous servir: solutions aqueusesGéométrie moléculaire et complexes aqueux de calcium
Au centre du parallélépige le ca2+ Il est entouré de six cl-. Quatre d'entre eux se trouvent dans un plan carré et les deux autres sont situés perpendiculairement (les sphères vertes les plus éloignées de la sphère blanche).
À la suite de la disposition de ces ions, autour du CA2+ Un octaedro est "arme", attribuant ainsi une géométrie moléculaire octaédrique.
Compte tenu de la disposition des sphères vertes, une molécule d'eau peut en remplacer une, qui se produit par la course2· H2Ou, peut-être dans le plan carré. Ce fait modifie la structure cristalline et, lorsque l'eau remplace les sphères vertes, l'agencement d'ions change plus.
Quand tous les ions CL- Ils sont remplacés par des molécules d'eau, l'hydrate de cacl est formé2· 6h2SOIT. À ce stade, l'octaèdre est "aqueux" et les molécules sont désormais capables d'interagir entre elles par des ponts d'hydrogène (CA2+ Oh-h-oh2).
Consécutivement, le calcium peut accepter encore plus de molécules d'eau sans modifier la proportion établie. Cela signifie que le cacl2· 6h2Ou peut adopter d'autres structures complexes, au point de considérer les polymères cristallins de calcium et d'eau.
Cependant, ces structures sont moins stables que celles érigées par des interactions électrostatiques (CA2+ et cl-) à partir du sel d'anhydride.
Utilisations / applications du chlorure de calcium
Les principales applications du chlorure de calcium sont:
- Évitez la congélation de l'eau pendant l'hiver. Le chlorure de calcium génère très de la chaleur lors de la dissolution puis, augmentant la température, la fusion de glace se produit. Pour cette raison, il est utilisé pour réduire le risque de circulation des personnes et des véhicules pendant la station froide.
- Aide à contrôler la poussière sur les routes non pavées.
- Accélérer la vitesse de séchage du béton une fois versée.
- Liquides de cachl2 L'efficacité du forage pour l'extraction de gaz à partir de leurs dépôts souterrains augmente, ainsi que le pétrole.
- Des piscines sont ajoutées pour réduire l'érosion subie par le béton de ses murs. Le calcium sédimenté remplit cette fonction.
- Parce qu'il s'agit d'un sel hygroscopique, le chlorure de calcium peut être utilisé comme dissecteur, pouvoir abaisser l'humidité de l'air environnant et, par conséquent, des substances en contact avec cet air.
- Il est utilisé comme conservateur dans certains aliments, ainsi que des additifs dans plusieurs, comme les boissons énergisantes utilisées par les athlètes, les fromages, les bières, etc.
- Dans la pratique médicale, il a également une utilité dans le traitement de la dépression causée par une surdose de sulfate de magnésium, ainsi que dans l'empoisonnement au plomb.
Synthèse du chlorure de calcium
Les sources naturelles de ce composé sont les salmueras extraits des mers ou des lacs.
Cependant, sa principale source provient du processus Solvay, dans lequel le calcaire (Caco3) subir une série de transformations jusqu'à dérive dans le chlorure de calcium par producteur:
2NACl (aq) + caco3(s) na2CO3(s) + cacl2(AC)
Le produit d'intérêt de ce processus est en fait du carbonate de sodium, NA2CO3.
Propriétés du chlorure de calcium
Propriétés physiques et délicturations
C'est un blanc, des toilettes et des solides hygroscopiques. Cette tendance à absorber l'humidité de l'environnement est due à la basicité des ions CA2+.
Basicité de quel type: de Lewis ou Bronsted? Lewis, parce que l'espèce positive est capable d'accepter les électrons. Ces électrons sont donnés, par exemple, par des atomes d'oxygène des molécules d'eau.
Le solide absorbe l'humidité au degré de dissolution dans la même eau qui assouplit ses cristaux. Cette propriété est connue sous le nom de délicescencia.
Sa densité est de 2,15 g / ml. Comme il intègre de l'eau dans sa structure, le cristal est «dilaté», augmentant son volume et, par conséquent, diminuant la densité. Seulement le cacl2· H2O Rompre avec cette tendance, montrant une plus grande densité (2,24 g / ml).
Le poids moléculaire du sel d'anhydride est d'environ 111 g / mol, et pour chaque molécule d'eau dans sa structure, ce poids augmente 18 unités.
Solubilité
Le cacl2 Il est très soluble dans l'eau et dans certains solvants polaires, comme l'éthanol, l'acide acétique, le méthanol et d'autres alcools.
Chauffer
Lorsque le processus est dissous dans l'eau, il est exothermique et, par conséquent, a chauffé la solution et son environnement.
Peut vous servir: d'où vient le plastique? Historique et typesC'est parce que le complexe aqueux stabilise mieux les ions CA2+ en solution que les interactions électrostatiques avec les ions CL-. Comme le produit est plus stable, le solide libère de l'énergie sous forme de chaleur.
Décomposition électrolytique
Le cacl2 La fusion peut être soumise à une électrolyse, un processus physique qui consiste en la séparation d'un composé dans ses éléments à partir de l'action d'un courant électrique. Dans le cas de ce sel, les produits sont du calcium métallique et du chlore gazeux:
Cacl2(l) → Ca (s) + cl2(g)
Les ions ca2+ Ils sont réduits dans la cathode, tandis que les ions climatisés- Ils sont oxydés à l'anode.
Les références
- Wikipédia. (2018). Chlorure de calcium. Récupéré de.Wikipédia.org
- Fhiver & Atkins. (2008). Chimie inorganique. Dans les éléments du groupe 2. (Quatrième édition., p. 278). Mc Graw Hill.
- Se publier. (2018). Chlorure de calcium. Récupéré de pubchem.NCBI.NLM.NIH.Gouvernement.
- Oxychem. Chlorure de calcium: un guide des propriétés physiques. Oxy a récupéré.com
- Carole Ann. Utilisations courantes du chlorure de calcium. Hunker récupéré.com