Histoire du chlore, propriétés, structure, risques, utilisations

- 3146
- 237
- Prof Ines Gaillard
Il chlore C'est un élément chimique qui est représenté par le symbole CL. C'est le deuxième des halogènes, situé sous le fluor, étant également le troisième élément le plus électronégatif de tous. Son nom dérive de sa couleur verte jaunâtre, qui est plus intense que celle du fluor.
Populairement quand quelqu'un écoute son nom ce qui pense en premier est dans les produits de blanchiment pour les vêtements et dans l'eau des piscines. Bien que le chlore fonctionne efficacement dans de tels exemples, ce n'est pas son gaz, mais ses composés (en particulier l'hypochlorite) qui exercent l'action décolorante et désinfectante.
 Flash rond avec du chlore gazeux à l'intérieur. Source: Larenmclane [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)]
Flash rond avec du chlore gazeux à l'intérieur. Source: Larenmclane [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)] Dans l'image supérieure, un ballon rond avec du chlore gazeux est montré. Sa densité est supérieure à celle de l'air, ce qui explique pourquoi elle reste dans le ballon et ne s'échappe pas vers l'atmosphère; Comme avec d'autres gaz plus légers, dire l'hélium ou l'azote. Dans cet état, c'est une substance extrêmement toxique, car elle produit de l'acide chlorhydrique dans les poumons.
C'est pourquoi le chlore élémentaire ou gazeux n'a pas trop d'utilisations, plus que dans une synthèse. Cependant, ses composés, que ce soit des sels ou des molécules organiques chlorées, couvrent un bon répertoire d'utilisations, placer au-delà des piscines et des vêtements de blanc extrême.
De plus, ses atomes sous forme d'anions de chlorure se trouvent dans notre corps, régulant les niveaux de sodium, de calcium et de potassium, ainsi que dans le jus gastrique. Sinon, la consommation de chlorure de sodium serait encore plus mortelle.
Le chlore se produit par l'électrolyse de la saumure, riche en chlorure de sodium, procédé industriel dans lequel l'hydroxyde de sodium et d'hydrogène sont également obtenus. Et parce que les mers sont une source presque inépuisable de ce sel, les réserves potentielles de cet élément dans l'hydrosphère sont très grandes.
[TOC]
Histoire
Premières approches
En raison de la forte réactivité du chlore gazeux, les civilisations anciennes n'ont jamais soupçonné leur existence. Cependant, leurs composés faisaient partie de la culture de l'humanité d'antan; Son histoire a commencé à être lié au sel commun.
D'un autre côté, le chlore est né d'éruptions volcaniques et lorsque quelqu'un a dissous de l'or dans l'eau royale; Mais aucune de ces premières approches n'a été suffisante pour formuler l'idée que ce gaz vert jaunâtre était un élément composé.
Découverte
La découverte du chlore est attribuée au chimiste suédois Carl Wilhelm Scheele, qui en 1774 a fait la réaction entre le minéral pyrolusite et l'acide chlorhydrique (alors appelé acide muriatique)).
Scheele reste avec le crédit car il a été le premier scientifique à étudier les propriétés du chlore; Bien qu'il ait été précédemment reconnu (1630) par Jan Baptist Van Helmont.
Les expériences avec lesquelles Scheele a obtenu ses observations est intéressante: il a évalué l'action décolorante du chlore sur les fleurs rougeâtre et bleuâtre, ainsi que dans les feuilles des plantes et des insectes qui sont morts instantanément.
Il a également informé son grand réactif envers les métaux, son odeur suffocante et son effet indésirable sur les poumons, et que lorsqu'il s'est dissous dans l'eau, son acidité a augmenté.
Acide oimuriatique
D'ici là, les produits chimiques ont considéré un acide pour tous les composés possédant de l'oxygène; Ils ont donc manqué le chlore devraient être un oxyde gazeux. C'était pour qu'ils l'appellent «l'acide oxyuriatique» (oxyde d'acide muriatique), nom inventé par le célèbre chimiste français Antoine Lavoisier.
Puis, en 1809, Joseph Louis Gay-Lussac et Louis Jacques Thénard ont tenté de réduire cet acide de carbone; réaction obtenue par les métaux de leurs oxydes. De cette façon, ils voulaient extraire l'élément chimique de l'acide oximuriatique présumé (qu'ils ont appelé «l'air défliste de l'acide muriatique».
Cependant, Gay-Lussac et Thénard ont échoué dans leurs expériences; Mais ils ont réussi en considérant que ledit gaz vert jaunâtre devrait être un élément chimique et non un composé.
Reconnaissance en tant qu'élément
La reconnaissance du chlore en tant qu'élément chimique était grâce à Sir Humphry Davy, qui en 1810 a effectué ses propres expériences avec des électrodes de charbon et a conclu qu'il y avait en effet un tel oxyde d'acide muriatique.
Et en plus, c'est Davy qui a inventé le nom de «chlore» pour cet élément du mot grec «chloros», ce qui signifie jaunâtre.
En étudiant les propriétés chimiques du chlore, il a été constaté que bon nombre de leurs composés avaient une nature saline; Par conséquent, ils l'ont nommé «halogène», ce qui signifie le formateur de vente. Ensuite, le terme halogène a été utilisé avec les autres éléments du même groupe (F, Br et I).
Michael Faraday a même réussi à liquéfier2· H2SOIT.
Peut vous servir: charge nucléaire efficaceLe reste de l'histoire du chlore est lié à ses propriétés de désinfectant et de blanchiment, au développement du processus industriel de l'électrolyse de la saumure pour produire des quantités massives de chlore.
Proprietes physiques et chimiques
Apparence physique
C'est un gaz dense vert jaunâtre opaque, une odeur d'acre irritante (une version super intensifiée du chlore commercial) et est également extrêmement toxique.
Numéro atomique (z)
17
Poids atomique
35,45 u.
Sauf indication contraire, le reste des propriétés correspond aux amplitudes mesurées pour le chlore moléculaire, Cl2.
Point d'ébullition
-34.04 ºC
Point de fusion
-101,5 ºC
Densité
-Dans des conditions normales, 3,2 g / L
-Juste au point d'ébullition, 1 5624 g / ml
Notez que le chlore liquide est environ cinq fois plus que son gaz. De plus, la densité de sa vapeur est 2,49 fois supérieure à l'air que l'air. C'est pourquoi dans la première image, le chlore n'a pas tendance à s'échapper du ballon rond, car être plus dense que l'air est situé en arrière-plan. Cette fonctionnalité fait toujours un gaz plus dangereux.
Chaleur de fusion
6 406 kJ / mol
Chaleur de vaporisation
20,41 kJ / mol
Capacité thermique molaire
33,95 J / (mol · k)
Solubilité dans l'eau
1,46 g / 100 ml à 0 ºC
La pression de vapeur
7,67 atm à 25 ºC. Cette pression est relativement faible par rapport à celle des autres gaz.
Électronégativité
3.16 sur l'échelle Pauling.
Énergies d'ionisation
-Premièrement: 1251.2 kJ / mol
-Deuxième: 2298 kJ / mol
-Troisièmement: 3822 kJ / mol
Conductivité thermique
8,9 · 10-3 W / (m · k)
Isotopes
Le chlore se produit dans la nature principalement comme deux isotopes: 35Cl, avec une abondance de 76%, et 37Cl, avec une abondance de 24%. Ainsi, le poids atomique (35,45 u) est une moyenne des masses atomiques de ces deux isotopes, avec leurs pourcentages respectifs d'abondance.
Tous les radio-isotopes du chlore sont artificiels, parmi lesquels le 36Cl comme le plus stable, avec une demi-vie de 300 000 ans.
Nombres d'oxydation
Le chlore peut avoir plusieurs nombres ou états d'oxydation lorsqu'il fait partie d'un composé. Étant l'un des atomes les plus électronégatifs du tableau périodique, il a généralement des nombres d'oxydation négatifs; sauf lorsqu'il fonctionne avec de l'oxygène ou du fluor, dans les oxydes et les fluorures, respectivement, il doit "perdre" des électrons.
Dans ses nombres d'oxydation, l'existence ou la présence d'ions avec la même ampleur de charge est supposée. Ainsi, nous avons: -1 (Cl-, Le célèbre chlorure anion), +1 (Cl+), +2 (cl2+), +3 (cl3+), +4 (cl4+), +5 (cl5+), +6 (cl6+) et +7 (cl7+). De tous, les -1, +1, +3, +5 et +7 sont les plus courants dans les composés chlorés.
Pour des exemples, dans le CLF et le CLF3 Les nombres d'oxydation du chlore sont +1 (Cl+F-) et +3 (cl3+F3-). Dans le cl2Ou, c'est +1 (CL2+SOIT2-)); Pendant son séjour dans le CLO2, CL2SOIT3 et cl2SOIT7, Fils +4 (CL4+SOIT22-), +3 (cl23+SOIT32-) et +7 (cl27+SOIT72-).
Dans tous les chlorures, en revanche, le chlore a un nombre d'oxydation de -1; Comme dans le cas de NaCl (na+CL-), Où il est valable de dire que le CL existe- Étant donné la nature ionique de ce sel.
Structure et configuration électroniques
Molécule de chlore
 Molécule de chlore diatomique représentée avec un modèle de remplissage d'espace. Source: Benjah-Bmm27 via Wikipedia.
Molécule de chlore diatomique représentée avec un modèle de remplissage d'espace. Source: Benjah-Bmm27 via Wikipedia. Les atomes de chlore dans leur état basal ont la configuration électronique suivante:
[NE] 3S2 3p5
Par conséquent, chacun d'eux a sept électrons de Valence. À moins qu'ils ne soient surchargés d'énergie, il y aura des atomes individuels dans l'espace, comme s'ils étaient des billes vertes. Cependant, sa tendance naturelle est de former des liens covalents entre eux, afin de compléter leurs octets de Valence.
Notez qu'ils ont à peine besoin d'un électron pour avoir huit électrons de valence, de sorte qu'ils forment un seul lien simple; C'est celui qui rejoint deux atomes CL pour créer la molécule CL2 (image supérieure), CL-CL. C'est pourquoi le chlore dans des conditions normales et / ou terrestres est un gaz moléculaire; Non-monoatomique, comme c'est le cas avec les gaz nobles.
Interactions intermoléculaires
La molécula CL2 Il est homonucléaire et apolaire, donc ses interactions intermoléculaires sont régies par les forces de dispersion de Londres et ses masses moléculaires. En phase de soude, la distance CL2-CL2 Il est relativement court par rapport aux autres gaz qui, ajouté sa masse, en fait un gaz trois fois plus que l'air.
La lumière peut exciter et promouvoir les transitions électroniques dans les orbitales moléculaires du CL2; Par conséquent, sa couleur vert jaunâtre caractéristique apparaît. Cette couleur s'intensifie à l'état liquide, puis disparaît partiellement lorsqu'il se solidifie.
Peut vous servir: bases faiblesLorsque la température descend (-34 ºC), les molécules CL2 Ils perdent l'énergie cinétique et la distance CL2-CL2 diminue; Par conséquent, ils cohérent et finissent par définir le chlore liquide. La même chose se produit lorsque le système (-101 ºC) est encore refroidi, maintenant avec les molécules CL2 donc ensemble qui définissent un cristal ortorrombique.
Le fait qu'il existe des cristaux de chlore indique que leurs forces dispersives sont suffisamment directionnelles pour créer un motif structurel; C'est, les couches moléculaires de Cl2. La séparation de ces couches est telle que même sous une pression de 64 GPa, sa structure est modifiée, et ils ne présentent pas de conducteur électrique.
Où est-il et obtenez
Sels de chlorure
 Les cristaux robustes d'Halita, mieux connu sous le nom de sel commun ou de table. Source: Parent Géry [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]
Les cristaux robustes d'Halita, mieux connu sous le nom de sel commun ou de table. Source: Parent Géry [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)] Le chlore dans son état gazeux ne peut être trouvé nulle part à la surface de la terre, car il est très réactif et a tendance à former des chlorures. Ces chlorures sont bien répartis dans la croûte terre.
Parmi tous les chlorures, le NaCl del Mineral Halita (image supérieure) est le plus courant et le plus abondant; suivi par les minéraux Silvina, KCL et Carnalita, MGCL2· KCL · 6H2SOIT. Lorsque les masses d'eau s'évaporent par l'action du soleil, laissent derrière eux des lacs de sel du désert, à partir desquels le NaCl peut être extrait directement sous forme de matière première pour le chlore.
Électrolyse de la saumure
NaCl se dissout dans l'eau pour produire une saumure (26%), à laquelle l'électrolyse est soumise à une cellule chloralcaline. Il y a deux semi-réactions dans les compartiments d'anode et de cathode:
2Cl-(Ac) => cl2(g) + 2e- (Anode)
2h2Ou (l) + 2e- => 2oh-(AC) + H2(g) (cathode)
Et l'équation globale des deux réactions est:
2NaCl (AC) + 2H2Ou (l) => 2naoh (ac) + h2(g) + cl2(g)
Au fur et à mesure que la réaction a lieu,+ formé à l'anode, ils migrent vers le compartiment cathode traversant une membrane d'amiante perméable. Pour cette raison, le NaOH est sur le côté droit de l'équation mondiale. Les deux gaz, CL2 et h2, Ils sont collectés à partir de l'anode et de la cathode, respectivement.
L'image inférieure illustre le nouveau écrit:
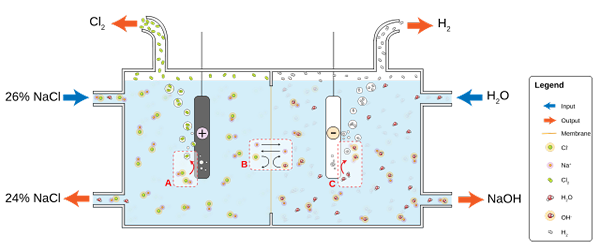 Diagramme pour la production de chlore par l'électrolyse de la saumure. Source: jkwchui [cc by-sa 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]
Diagramme pour la production de chlore par l'électrolyse de la saumure. Source: jkwchui [cc by-sa 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)] Notez que la concentration de la saumure à la fin diminue de 2% (elle passe de 24 à 26%), ce qui signifie qu'une partie de son Cl- originaux transformés en molécules CL2. En fin de compte, l'industrialisation de ce processus a accordé une méthode pour produire du chlore, de l'hydrogène et de l'hydroxyde de sodium.
Dissolution acide de la pyrolusite
Comme mentionné dans la section d'histoire, le chlore gazeux peut être produit en dissolvant des échantillons de minerai de pyrolusite avec de l'acide chlorhydrique. L'équation chimique suivante montre les produits obtenus à partir de la réaction:
Mne2(s) + 4hcl (ac) => mcl2(AC) + 2H2Ou (l) + cl2(g)
Alliages
Il n'y a pas d'alliages de chlore pour deux raisons simples: leurs molécules gazeuses ne peuvent pas être piégées entre les cristaux métalliques, et ceux-ci sont également très réactifs, ils réagiraient donc immédiatement avec des métaux pour produire leur chlorure respectif.
D'un autre côté, les chlorures ne sont pas souhaitables non plus, car une fois dissous dans l'eau, ils exercent un effet salin qui favorise la corrosion dans les alliages; Et donc, les métaux se dissolvent pour former des chlorures métalliques. Le processus de corrosion pour chaque alliage est différent; Certains sont plus sensibles que d'autres.
Le chlore, par conséquent, n'est pas du tout un bon additif pour les alliages; ni comme Cl2 ni comme Cl- (Et les atomes seraient très réactifs pour qu'ils puissent même exister).
Des risques
Bien que la solubilité du chlore dans l'eau soit faible, il suffit de produire dans l'humidité de notre peau et les yeux de l'acide chlorhydrique, qui finit par corroder les tissus provoquant de graves irritations et même une perte de vision.
Pire encore, c'est respirer leurs vapeurs verdâtres jaunâtres, car une fois dans les poumons, il génère à nouveau des acides et endommage le tissu pulmonaire. Avec cela, la personne éprouve des douleurs de gorge, de la toux et des difficultés respiratoires à cause des fluides formés dans les poumons.
S'il y a une évasion du chlore, il fait face à une situation particulièrement dangereuse: l'air ne peut pas simplement "balayer" ses vapeurs; restez là jusqu'à ce qu'ils réagissent ou se dispersent lentement.
Peut vous servir: équilibre de précision: caractéristiques, fonctions, pièces, utilisationsEn plus de cela, c'est un composé très oxydant, donc plusieurs substances peuvent réagir de manière explosive avec lui au moindre contact; Comme pour la laine d'acier et l'aluminium. C'est pourquoi là où il y a un chlore stocké, toutes les considérations nécessaires doivent être prises pour éviter les risques d'incendie.
Ironiquement, bien que le chlore gazeux soit mortel, son anion chlorure n'est pas toxique; Il peut être consommé (avec modération), ne brûle pas, ni ne réagit que avec le fluor et d'autres réactifs.
Applications
La synthèse
Environ 81% du chlore gazeux produit chaque année est destiné à la synthèse de chlorures organiques et inorganiques. Selon le degré de covalence de ces composés, le chlore peut être trouvé comme de simples atomes CL dans les molécules organiques chlorées (avec des liaisons C-Cl), ou comme des ions CL- Dans quelques sels de chlorure (NaCl, CACL2, MGCL2, etc.).
Chacun de ces composés a ses propres applications. Par exemple, chloroforme (chcl3) et le chlorure d'éthyle (ch3Ch2Cl) sont des solvants qui sont devenus utilisés comme anesthésiques d'inhalation; Le diclorométano (ch2CL2) et le tétrachlorure de carbone (CCL4), Pour leur part, ils sont largement utilisés dans les laboratoires de chimie organique.
Lorsque ces composés chlorés sont liquides, la plupart du temps, ils sont destinés comme des solvants pour les réactions organiques signifie.
Dans d'autres composés, la présence d'atomes de chlore représente une augmentation au moment dipolaire, de sorte qu'ils peuvent interagir dans une plus grande mesure avec une matrice polaire; A formé par des protéines, des acides aminés, des acides nucléiques, etc., biomolécules. Ainsi, le chlore a également du papier dans la synthèse de médicaments, de pesticides, d'insecticides, de fongicides, etc.
En ce qui concerne les chlorures inorganiques, ils sont généralement utilisés comme catalyseurs, matière première pour obtenir des métaux par électrolyse ou des sources de clôture-.
Biologique
Le chlore gazeux ou élémentaire n'a pas plus de rôle dans les êtres vivants que de détruire leurs tissus. Cependant, cela ne signifie pas que leurs atomes ne peuvent être trouvés dans le corps. Par exemple, CL IONS- Ils sont très abondants dans le milieu cellulaire et extracellulaire, et aident à contrôler les niveaux de nations+ et CA2+, surtout.
De même, l'acide chlorhydrique fait partie du jus gastrique avec lequel la nourriture est digérée dans l'estomac; Ses climatives-, En compagnie de h3SOIT+, Définissez le pH près de 1 de ces sécrétions.
Armes chimiques
La densité du chlore gazeux en fait une substance mortelle lorsqu'elle est renversée ou versée dans des espaces fermés ou ouverts. Étant plus dense que l'air, un courant de celui-ci ne traîne pas facilement le chlore, il reste donc pendant un temps considérable avant de finalement se disperser.
Pendant la Première Guerre mondiale, par exemple, ce chlore a été utilisé dans les champs de bataille. Une fois libéré, il s'est faufilé dans les tranchées pour étouffer les soldats et les forcer à aller à la surface.
Désinfectant
 Les piscines sont chloronisées pour éviter la reproduction et la propagation des micro-organismes. Source: Pixabay.
Les piscines sont chloronisées pour éviter la reproduction et la propagation des micro-organismes. Source: Pixabay. Les solutions chloronisées, celles où le chlore gazeux ont été dissous dans l'eau puis sont alcalisés avec un tampon, ont d'excellentes propriétés désinfectantes, ainsi que d'inhiber la pourriture des tissus. Ils ont été utilisés pour désinfecter les plaies ouvertes pour éliminer les bactéries pathogènes.
L'eau de la piscine est précisément chloronisée pour éliminer les bactéries, les microbes et les parasites qui peuvent le héberger. À cette fin, le chlore gazeux était utilisé, mais son action est assez agressive. Au lieu de cela, des solutions d'hypochlorite de sodium (blanchi) ou de l'acide trichloroisocianurique (ATC) sont utilisées (ATC).
Le précédent montre que ce n'est pas le CL2 Celui qui exerce l'action désinfectante mais le HCLO, l'acide hypochlorite, qui produit des radicaux ou · qui détruisent les micro-organismes.
Eau de Javel
Très similaire à son action de désinfectante, le chlore blanchit également les matériaux parce que les couleurs responsables du HCLO. Ainsi, ses solutions chloronisées sont idéales pour éliminer les taches des vêtements blancs ou pour blanchir la pulpe de papier.
Chlorure de polyvinyle
Le composé chloré le plus important de tous, pour lequel environ 19% de la production restante de chlore gazeux est allouée, est le polychlorure de vinyle (PVC). Ce plastique a plusieurs utilisations. Avec lui, les conduites d'eau sont fabriquées, les cadres de fenêtres, les murs des murs et des planchers, le câblage électrique, les sacs intraveineux, les manteaux, etc.
Les références
- Fhiver & Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Wikipédia. (2019). Chlore. Récupéré de: dans.Wikipédia.org
- Laura H. et al. (2018). Structure du chlore solide à 1.45 gpazeitschrift für kristallgraphie. MATÉRIAUX cristallins, volume 234, numéro 4, pages 277-280, ISSN (en ligne) 2196-7105, ISSN (imprimer) 2194-4946, doi: doi.org / 10.1515 / zkri-2018-2145
- Centre national d'information sur la biotechnologie. (2019). Chlore. Base de données PubChem. CID = 24526. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement
- Marques Miguel. (s.F.). Chlore. Récupéré de: Nautilus.FIS.UC.Pt
- American Chemistry Council. (2019). Chimie du chlore: Introduction au chlore. Récupéré de: chlore.Amérique.com
- Fong-yan ma. (s.F.). Effets corrosifs des chlorures sur les métaux. Département de génie maritime, République de Chine Ntou (Taïwan).
- État de New York. (2019). Les faits sur le chlore. Récupéré de: santé.New York.Gouvernement
- Docteur. Doug Stewart. (2019). Faits d'élément chlore. Chimicool. Récupéré de: Chemicool.com

