Citocrome C Oxydase Structure, fonctions, inhibiteurs
- 979
- 46
- Paul Dumas
La Citrocrome c oxydase Il s'agit d'un complexe protéique enzymatique qui peut traverser la bicouche lipidique de la membrane cellulaire. C'est que nous avons été principalement associés à la membrane interne des mitochondries, étant à la fois dans les organismes procaryotes (bactéries), comme chez les eucaryotes (unicellulaires et multicellulaires).
Également appelée complexe IV, cette enzyme est vitale dans les fonctions métaboliques aérobies des organismes, car elle est essentielle dans la chaîne de transport d'électrons dans laquelle la cellule brûle les sucres et capture une partie de l'énergie libérée pour stocker l'adénosine trypphosphate ou l'ATP.
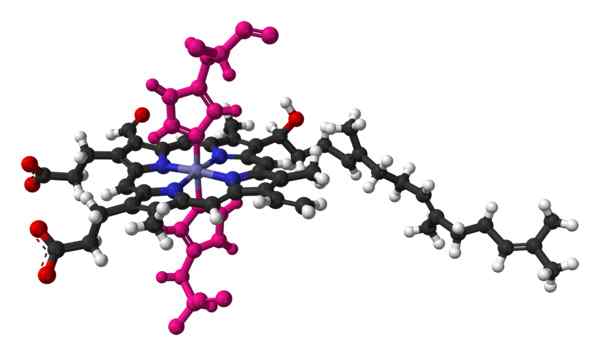
 Modèle de Bola et Palo de l'hémo, d'une molécule trouvée dans la structure cristalline de la cytochrome c oxydase du cœur bovin. Pris et édité à partir de: Benjah-Bmm27 [domaine public].
Modèle de Bola et Palo de l'hémo, d'une molécule trouvée dans la structure cristalline de la cytochrome c oxydase du cœur bovin. Pris et édité à partir de: Benjah-Bmm27 [domaine public]. Le nom du cytochrome signifie "pigments cellulaires". Ce sont des protéines de sang qui transportent des électrons. Les cytochromes ont été découverts par le docteur irlandais Charles Alexander Macmunn en 1884. Macmunn a été un pionnier dans la découverte du pigment respiratoire du sang, appelé aujourd'hui le cytochrome 1.
Dans les années 20 de l'entomologiste et parasitologue russe du siècle dernier. Bien que Macmunn les ait découverts en 1884, la communauté scientifique avait oublié et même certains avaient mal compris leur travail.
[TOC]
Caractéristiques générales
En général, les pigments respiratoires ont des spectres visibles caractéristiques. Il est connu qu'il existe au moins quatre complexes de protéines membranaires complets où il existe 5 types différents de cytochromes: A, A3, B, C1 et C, classés en fonction des longueurs d'onde du maximum d'absorption spectrale.
Ils se trouvent généralement dans la membrane interne des mitochondries. Cependant, ils ont également été observés dans le réticulum endoplasmique et les chloroplastes, dans les organismes eucaryotes et procaryotes.
Ils présentent le groupe prothétique hémo contenant du fer (foi). Chacun des cytochromes connus agit dans des complexes multitienzimatiques dans le transport des électrons de la chaîne respiratoire.
Les cytochromes ont la fonction de participer à des réactions de réduction de l'oxyde. Les réactions de réduction, où ils acceptent les électrons, se produisent différemment pour chaque type de cytochrome, et leur valeur est déterminée par l'écoulement des électrons de la chaîne respiratoire.
-Cytochrome c
Quatre types de cytochrome C sont connus, qui sont les suivants.
Classe I
Au sein de cette classe se trouvent les cytochromes c. Ce sont des octaédales. Le site Hemo Union est à la fin de l'histidine et le sixième ligand est fourni par un résidu de métification à la fin C.
De cette classe, vous pouvez même reconnaître plusieurs sous-classes, qui ont été déterminées leur structure à trois dimensions.
Classe II
Dans cette classe, il y a des cytocromes C de High Turn (Highspin) et un peu de virage bas. Les tours élevés sont le site de liaison près de l'End-C, et dans ceux qui ont un virage bas, le sixième ligand semble être un résidu de métification près de la fin du N-terme en anglais). Ils sont pentacoordonnés avec le cinquième ligand histidine.
Peut vous servir: turgidité (biologie)Classe III
Cette classe est caractérisée par des cytochromes C avec plusieurs hémo (C3 et C7) et un réducteur d'oxyde potentiel faible, avec seulement 30 résidus d'acides aminés par hémo. Dans les représentants de cette classe, les groupes Hemo C ont une structure et des fonctions non équivalentes, en plus de présenter différents potentiels redox. Ce sont des octaédales.
Classe IV
Selon certains auteurs, cette classe n'a été créée que pour inclure des protéines complexes présentées par d'autres groupes prothétiques, ainsi que Hemo C, ou flavocytocrome C, entre autres.
La cytochrome c oxydase ou le complexe IV
La cytochrome c oxydase est une enzyme mitochondriale qui effectue la phase finale du transport électronique dans la respiration cellulaire. Cette enzyme catalyse le transport d'électrons du cytochrome C réduit à l'oxygène.
Certains composés chimiques tels que le cyanure, le dioxyde de carbone et l'azid. D'autres formes d'inhibition du complexe IV sont des mutations génétiques.
Du point de vue évolutif, la cytochrome c oxydase ne se trouve que dans les organismes aérobies, et plusieurs groupes de scientifiques suggèrent que la présence de cette protéine indique des relations évolutives où les plantes, les champignons et les animaux partageaient également un ancêtre en commun.
Structure
Le cytochrome c oxydase forme un complexe homodimérique, c'est-à-dire composé de deux monomères similaires dans la membrane interne des mitochondries. Le complexe enzymatique se compose de 3 à 4 sous-unités dans les organismes procaryotes et jusqu'à un maximum de 13 (certains suggèrent 14) des polypeptides dans les organismes tels que les mammifères.
Dans ces organismes, 3 polypeptides sont d'origine mitochondriale et le reste provient du noyau. Chaque monomère a 28 hélices transmembranaires qui séparent les domaines hydrophiles de la matrice membranaire et de l'espace intermembranaire.
Il n'a qu'une seule unité catalytique, qui se trouve dans toutes les enzymes qui catalysent les réactions d'oxydation / réduction, en utilisant de l'oxygène moléculaire (oxydases, en particulier l'hémo-Cobre). Le complexe contient les cytochromes A et A3 unis par la sous-unité I et deux centres de cuivre.
Il présente un ou plusieurs groupes Hemo C liés à la structure des protéines environnantes par un ou plusieurs (généralement deux) liaisons tioreter. D'autres auteurs suggèrent qu'il existe un seul groupe Hemo C lié à la protéine entre l'anneau de porphyrine et deux résidus de cystéine.
Le seul groupe Hemo C mentionné ci-dessus, est entouré de déchets hyodrophobes et est hexacoordininé, étant de l'histidine en position 18 de la chaîne polypeptidique et de la méthodin en 80.
Peut vous servir: cellule végétale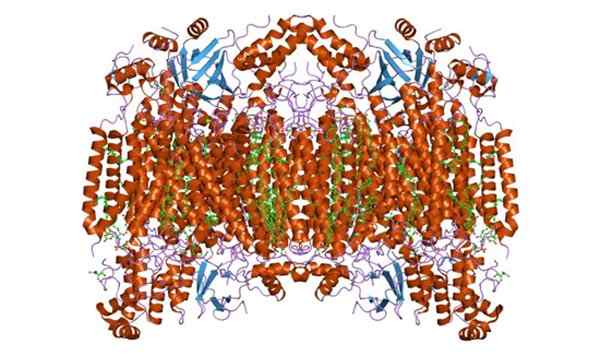 Cytochrome c oxydase Sous-unité F. Pris et édité de: Jawahar Swaminathan et le personnel de MSD à l'Institut européen de bioinformatique [domaine public]
Cytochrome c oxydase Sous-unité F. Pris et édité de: Jawahar Swaminathan et le personnel de MSD à l'Institut européen de bioinformatique [domaine public] Les fonctions
Citocrome C oxydases sont des protagonistes de trois mécanismes physiologiques primaires, que nous verrons ci-dessous.
Apoptose ou mort cellulaire programmée
L'apoptose est la destruction ou la mort cellulaire programmée, causée par le même organisme et qui vise à contrôler la croissance, le développement, l'élimination des tissus endommagés et la régulation du système immunitaire. Dans ce processus physiologique, la cytochrome c oxydase participe en tant qu'intermédiaire.
Cette protéine, libérée par les mitochondries, conduit à une interaction avec le réticulum endoplasmique, qui provoque la sécrétion ou la libération de calcium. L'augmentation progressive du calcium déclenche une libération massive de cytochrome c oxydase, jusqu'à ce qu'il soit possible d'atteindre les niveaux cytotoxiques de calcium.
Les niveaux de calcium cytotoxiques et la libération de cytochromes C provoquent l'activation en cascade de plusieurs enzymes, qui sont responsables de la destruction des cellules.
Régénération des cellules ou des tissus
Plusieurs études indiquent que lorsque la cytochrome c oxydase est exposée à des longueurs d'onde de 670 nanomètres, participe à un complexe fonctionnel, qui pénètre dans le tissu endommagé ou blessé et augmente la vitesse de régénération cellulaire.
Le métabolisme énergétique
C'est peut-être la fonction la plus connue et la plus pertinente de la cytochrome c oxydase. C'est précisément le complexe oxydase (de la chaîne respiratoire) qui en charge de la collecte des électrons du cytochrome C et les transfère à la molécule d'oxygène, la réduisant à deux molécules d'eau.
Connecté à ce processus, il y a une translocation de protons à travers la membrane, ce qui entraîne la génération d'un gradient électrochimique que le complexe ATP synthésase utilise pour produire ou synthétiser l'ATP (Adenosín triffisphyte).
Inhibiteurs
Le citocrome C oxydase est inhibé par plusieurs processus et composés chimiques. La façon dont il se produit peut survenir comme un moyen naturel de réguler la production ou l'action de l'enzyme ou peut se produire accidentellement en raison de l'empoisonnement.
En présence d'Azid. Cela provoque une interruption du processus respiratoire cellulaire et provoque donc l'asphyxie chimique des cellules.
D'autres composés tels que l'oxyde nitrique, le sulfure d'hydrogène, le méthanol et certains alcools méthylés provoquent également l'inhibition du cytochrome c oxydase.
Carence
La cytochrome c oxydase est une enzyme contrôlée par les gènes du noyau et des mitochondries. Il y a des altérations génétiques ou des mutations qui peuvent comporter une carence en cytochrome c oxydase.
Ces mutations perturbent la fonctionnalité de l'enzyme, car elles modifient leur structure enzymatique, entraînant avec elles des troubles métaboliques pendant le développement embryonnaire (selon des études sur l'homme), ce qui affectera plus tard l'organisme au cours de leurs premières années de vie.
Peut vous servir: cellules dendritiques: caractéristiques, fonction, typesLa carence en cytochrome C oxydase affecte les tissus à forte demande d'énergie, comme le cœur, le foie, le cerveau et les muscles. Les symptômes de ces mutations sont reflétés avant les deux années de vie et peuvent se manifester comme des conditions fortes ou douces.
Des symptômes légers peuvent être observés même peu de temps après la première année et généralement les personnes atteintes d'eux n'ont qu'une diminution de la tension musculaire (hypotonie) et de l'atrophie musculaire (myopathie).
D'un autre côté, les individus qui présentent des symptômes plus forts peuvent avoir une atrophie musculaire et une encéphalyopathie. Les autres conditions causées par l'absence de cytochrome c oxydase sont la myocardiopathie hypertrophique, l'augmentation pathologique de la taille du foie, du syndrome de Leight et de l'acidose lactique.
Utilisations en phylogénie
La phylogénie est la science qui est responsable des études d'origine, de formation et de développement évolutif du point de vue de l'ancêtre-descendant, des organismes. Au cours des dernières décennies, les études de phylogénie avec l'analyse moléculaire ont été de plus en plus fréquentes, jetant beaucoup d'informations et résolvant des problèmes taxonomiques.
En ce sens, certaines études phylogénétiques indiquent que l'utilisation de cytochrome c oxydases peut aider à établir des relations évolutives. En effet.
Exemple de cela, sont les tests effectués avec les humains, les chimpanzés (Pain) et les macaques rhésus (Mulatta Macaca). De tels tests ont révélé que les molécules de cytochrome c oxydase des humains et des chimpanzés étaient identiques.
Il a également montré que les molécules de cytochrome c oxydase du macaque rhésus.
Les références
- R.P. Ambler (1991). Variation de séquence dans les cycromes bactériens C. Biochimica et Biophysica Acta (BBA) - Bioenergetics.
- Cytochrome c. Récupéré de newworldyclopedia.org.
- V.Colman, E. Coûter. Chaves, v. Tortora (2015). Rôles biologiques du cytochrome C: transport électronique mitochondrial, mort cellulaire programmée et gain de activité AUS. Annales de la Faculté de médecine.
- Cytochrome c oxydase Sous-unité I. Récupéré d'EBI.CA.ROYAUME-UNI.
- L. Youfen, P. Jeong-oon, D. Jian-Hong & B. Yidong (2007). La sous-unité IV de cytochrome C oxydase est essentielle pour l'assemblage et la fonction respiratoire du complexe enzymatique. Journal of Bioenergetics and Biomembranes.
- Groupe de gènes: complexe IV mitochondrial: sous-unités de cytochrome c oxydase (COX, MT-CO). Récupéré de Genenames.org.
- ET.F. Hartree (1973). La découverte du cytochrome. Éducation biochimique.
- Citocrome C oxydase, déficit de .. . Récupéré d'Ivami.com.
- C.K. Mathews, k.ET. Van Hold & K.g. Ahern (2002). Biochimerie. 3e édition. Benjamin / Cummings Publishing Company, Inc.
- « Caractéristiques d'Opotillo, habitat, propriétés et ravageurs
- Caractéristiques de Pinus Patula, habitat, taxonomie, utilisations, ravageurs »

