Acides et bases Différences, caractéristiques, exemples
- 4903
- 1247
- Mlle Ambre Dumont
Les acides et bases Ce sont des composés chimiques qui ne présentent pas une seule définition, mais plusieurs, qui dépendent des caractéristiques ou des propriétés prises en considération. En termes généraux, on pourrait dire que les acides sont des substances aigres, tandis que les bases sont saponáceas ou savons.
Les définitions les plus importantes, telles que Brönsted-Lowry, ou Arrhenius, se concentrent davantage sur la libération des ions H3SOIT+ (Hydronium) u oh-(hydroxyle) par ces substances. Soit dans ses formes pures ou dissoutes dans l'eau.
Une définition qui survient en conséquence de ce qui précède est la suivante: Les acides dissous dans l'eau génèrent des solutions avec des valeurs de pH inférieures à 7, tandis que les bases dissous produisent des solutions avec des valeurs de pH supérieures à 7. Le pH est précisément un moyen d'exprimer à quel point un liquide est acide ou basique qui tient compte de la concentration de H3SOIT+.
Par conséquent, les substances acides, comme le jus d'orange, ont un pH inférieur à 7 et de nombreux ions H3SOIT+. Alors que les bases, comme legía, ont un pH supérieur à 7 et de nombreux ions OH-.
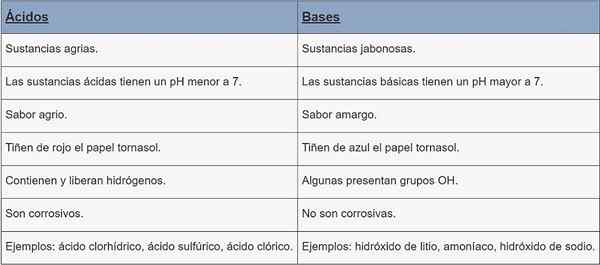
Acides | Bases | |
Type de substance | Substances agraires. | Substances Jabonesas. |
pH | pH moins de 7. | pH supérieur à 7. |
Saveur | Aigre. | Amer. |
Tasage | Papier du bassin versant. | Colorant en papier de maïs Bleu. |
Caractéristiques | Ils contiennent et libèrent des hydrogènes. | Certains groupes OH présents. |
Corrosion | Ils sont corrosifs. | Ils ne sont pas corrosifs. |
Exemples | Acide chlorhydrique, acide sulfurique, acide chlorique. | Hydroxyde de lithium, ammoniac, hydroxyde de sodium. |
Acides
 Le jus d'orange est l'un des représentants d'acide les plus connus de notre vie quotidienne
Le jus d'orange est l'un des représentants d'acide les plus connus de notre vie quotidienne Caractéristiques acides
Les substances acides ont certaines caractéristiques:
Goût acide
Les acides ont un goût aigre. Rardisamment, un type de saveur est désigné avec le terme «acide». Ainsi, on dit que le jus de citron et le liquide de la gomme sont des acides, car ses saveurs sont aigres et fortes pour le palais.
Papier du bassin versant
Les acides sont des substances capables de tourner la couleur du papier de pulvérisation bleu en rouge. ShortaSol fait partie d'un ensemble de substances qui peuvent changer de couleur en fonction du degré d'acidité ou de basicité de l'environnement dans lequel ils sont trouvés. Ces substances sont appelées indicateurs de pH.
Peut vous servir: propriétés coligatives des solutionsIls contiennent et libèrent des hydrogènes
Les acides sont des composés chimiques qui ont l'élément chimique hydrogène (H), ce qui lui donne sa caractéristique d'acidité.
De nombreuses autres substances contiennent également de l'hydrogène, mais elles ne peuvent pas la libérer comme cela se produit avec les acides. Lorsqu'il est libérateur, l'hydrogène est sous forme d'ions ou de cations+. Ces H+, Lorsque vous rencontrez les molécules d'eau, elles sont ajoutées à celles-ci pour former les ions H3SOIT+.
Ils transportent le courant électrique
En raison des atomes H+ qui sont libérés lorsque les acides dans l'eau sont dissous, ceux-ci sont capables de transporter l'électricité par l'utilisation de batteries ou de batteries.
Ils sont corrosifs
Il y a des acides forts qui sont très corrosifs. Par conséquent, le contact avec eux doit être évité, car ils peuvent causer de graves dommages physiques. Même les acides faibles, à des concentrations très élevées, comme l'acétique (le vinaigre) peuvent brûler la peau et le pharynx si leurs vapeurs sont respiratoires.
Fort et faible
Les acides forts produisent une grande concentration d'ions H3SOIT+ Quand ils se dissolvent dans l'eau. On dit que les atomes d'hydrogène des acides forts sont facilement dissociés. Pendant ce temps, les acides faibles libèrent peu d'atomes d'hydrogène et produisent donc une concentration plus faible d'ions H3SOIT+.
Les acides forts ont un pH très faible, qui en fonction de la concentration et de la force d'acide, il peut être 1 ou moins. Au lieu de cela, les acides faibles ont un pH acide plus élevé, qui peut être par exemple 4 ou 5.
Les acides forts ont une odeur qui produit une sensation de brûlure. Pendant ce temps, les acides faibles ne présentent pas ce type d'odeur, même dans certains cas, ils ont des odeurs agréables. Cependant, il existe de nombreuses exceptions, ils ne sont donc pas recommandés pour sentir même les acides faibles.
Peut vous servir: Oxyde de fer (iii): structure, nomenclature, propriétés, utilisationsLes acides forts sont de bons transporteurs d'électricité. Au contraire, les acides faibles sont de mauvais conducteurs d'électricité en libérant peu d'atomes H+.
Les acides forts sont capables d'attaquer des métaux, comme le zinc, formant un grand nombre de bulles d'hydrogène. Cette réaction n'est pas produite par des acides faibles.
Exemples d'acides
Acides forts
-HCl: acide chlorhydrique
-H2Swin4: acide sulfurique
-HBR: acide bromhydrique
-Salut: acide yodhydrique
-HNO3: acide nitrique
-Hclo4: acide perchlorique
-Hclo3: Acide chlorique
Acides faibles
-Ch3COOH: acide acétique
-HNO2: Acide nitreux
-H2CO3: Acide carbonique
-H3Pote4: acide phosphorique
-C3H5O (COOH): acide citrique
-HF: acide fluorhydrique
-H2Swin3: Acide sulfureux
Bases
 L'ammoniac est une substance de base
L'ammoniac est une substance de base Caractéristiques de base
Les bases présentent les caractéristiques suivantes:
-Ils produisent une sensation visqueuse ou de savon dans les doigts, ce qui fait que les mains deviennent glissantes les objets.
-Ils ont un goût amer.
-Ils peuvent réagir avec les acides, produisant la formation de composés appelés sels. Dans certains cas, ceux-ci peuvent précipiter ou s'enfoncer dans l'eau. De plus, dans la réaction d'une base avec un acide, l'eau se forme.
-Ils tournent la couleur du papier Sprout bleu, indiquant que la solution a un pH supérieur à 7 ou alcalin.
-Certaines bases sont présentes dans leurs groupes de formule chimique OH, appelés hydroxilli, qui sont formés par un atome d'hydrogène et un atome d'oxygène.
Fort et faible
Les bases fortes sont des composés chimiques qui présentent un ou plusieurs groupes OH dans leur structure chimique, qui lorsqu'ils entrent en contact avec de l'eau acquièrent une charge négative, OH-.
Pendant ce temps, les bases faibles ne se présentent pas dans leurs groupes de formule chimique. Cependant, les bases faibles lorsqu'ils réagissent avec l'eau produisent également des ions ou des anions oh-.
Des bases fortes, comme l'hydroxyde de sodium, ont des valeurs de pH très élevées, près de 14. Pendant ce temps, les bases faibles ont un pH inférieur, comme l'ammoniac, qui a un pH de 11.
Peut vous servir: bouillir: concept, types et exemplesDes bases fortes sont utilisées dans les maisons pour découvrir les drains. Tel est le cas de l'hydroxyde de potassium. Pendant ce temps, les bases faibles sont utilisées dans les travaux de nettoyage, comme l'ammoniac présent dans de nombreux nettoyeurs.
Exemples de bases
Bases fortes
-LioH: hydroxyde de lithium
-NaOH: hydroxyde de sodium
-Koh: hydroxyde de potassium
-RBOH: Hydroxyde de Rubidio
-CSOH: hydroxyde de césium
-SR (OH)2: Hydroxyde de strontium
-Ba (oh)2: hydroxyde de baryum
Bases faibles
-NH3: l'ammoniac
-Nhet2: diéthylamine
-NH2Ch3: Métilamine
-C5H5N: pyridine
Différences entre les acides et les bases
Ions qui libérent
Les acides libèrent les atomes H+ ou h3SOIT+ Quand ils se dissolvent dans l'eau. Pendant ce temps, les bases se libèrent ou produisent en contact avec les ions d'eau oh-.
Valeurs de pH
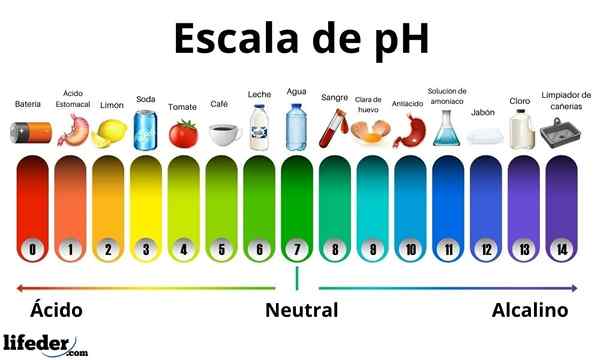
Les acides ont une valeur de pH entre 0 et 7. Pendant ce temps, les bases ont une valeur de pH entre 7 et 14. Par conséquent, les acides tournent la couleur du papier germe et les bases le tournent en bleu.
Réactions de formation
Les acides proviennent de la réaction des oxydes d'éléments non métalliques, par exemple le chlore, le soufre, etc., Avec de l'eau, ou ils sont également formés lorsque l'hydrogène est combiné avec un élément non métallique, puis le composé formé se dissout dans l'eau (HF, HCl, HBR, etc.).
Les bases sont produites par la réaction d'oxyde d'un métal, par exemple le fer, le cuivre, le magnésium, etc., Avec de l'eau. Il faut se rappeler qu'un oxyde est la combinaison d'atomes d'oxygène avec tout autre élément chimique.
Les références
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning.
- Helmestine, Anne Marie, Ph.D. (11 février 2020). Définition et exemple d'acide. Récupéré de: Thoughtco.com
- Explorateurs scientifiques. (31 juillet 2018). Enseigner aux enfants les acides et les bases. Récupéré de: ScienceExplorers.com
- Rédaction d'exemple. (2013). Caractéristiques acides. Récupéré de: exemplaire.com
- Chimie de la lumière pour les non-majors. (s.F.). Propriétés des acides et des bases. Récupéré de: cours.Lumenarning.com
- Clark Jim. (2013). Bases fortes et faibles. Récupéré de: Chemguide.co.ROYAUME-UNI
- « Flore et faune des espèces représentatives de Sierra équatorien
- Cadre méthodologique comment l'écrire, structure, exemples »

