Structure d'acide nitreux (HNO2), propriétés, synthèse

- 2872
- 797
- Justine Charpentier
Il acide nitreux C'est un acide inorganique faible, dont la formule chimique est HNO2. Il est fondamentalement en solution aqueuse avec une coloration bleu pâle. Il est très instable, et il est rapidement divisé en oxyde nitrique, non, et en acide nitrique, ino3.
Il est généralement en solution aqueuse sous forme de nitrites. Il vient également naturellement de l'atmosphère à la suite de la réaction de l'oxyde nitrique avec l'eau. Là, spécifiquement dans la troposphère, l'acide nitreux intervient dans la régulation de la concentration d'ozone.
 Solution d'acide nitreux dans un bécher. Source: Aucun auteur lisible par machine fourni. Le scientifique fou ~ Commonswiki a supposé (sur la base des réclamations du droit d'auteur). [Domaine public]
Solution d'acide nitreux dans un bécher. Source: Aucun auteur lisible par machine fourni. Le scientifique fou ~ Commonswiki a supposé (sur la base des réclamations du droit d'auteur). [Domaine public] Dans l'image supérieure, une solution HNO est montrée2 où la couleur bleu pâle caractéristique de cet acide peut être vue. Il est synthétisé par la dissolution du trioxyde d'azote, n2SOIT3, Dans l'eau. De même, c'est le produit de l'acidification des solutions de nitrite de sodium à basse température.
Le HNO2 Il a peu d'utilisation commerciale, en utilisant sous forme de nitrite dans la conservation de la viande. D'un autre côté, il est utilisé dans l'élaboration des colorants azoïques.
Il est utilisé, avec le thiosulfate de sodium, dans le traitement des patients présentant un empoisonnement au cyanure de sodium. Mais c'est un agent mutagène, et on pense qu'il peut provoquer des substitutions dans les bases des chaînes d'ADN, par une désamination oxydative de la cytosine et de l'adénine.
L'acide nitreux a un double comportement, car il peut se comporter comme un agent oxydatif ou comme un agent réducteur; c'est-à-dire qu'il peut être réduit à non ou n2, oxyder3.
[TOC]
Structure d'acide nitreux
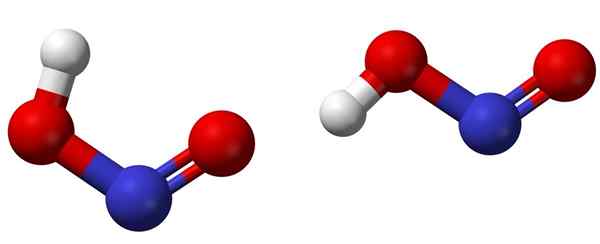 Isomères cis (gauche) et trans (à droite) avec les structures moléculaires respectives de HNO2. Source: Ben Mills [domaine public].
Isomères cis (gauche) et trans (à droite) avec les structures moléculaires respectives de HNO2. Source: Ben Mills [domaine public]. L'image supérieure montre la structure moléculaire de l'acide nitreux au moyen d'un modèle de sphères et de barres. L'atome d'azote (sphère bleue) est situé au centre de la structure, formant une double liaison (n = o) et une simple (N-O) avec des atomes d'oxygène (sphères rouges).
Notez que l'atome d'hydrogène (sphère blanche) est liée à l'un de l'oxygène et non directement à l'azote. Donc, sachant cela, la formule structurelle du HNO2 Il est [ho-n = o] ou [non (oh)], et il n'y a pas de liaison H-N (comme la formule chimique peut le penser).
Les molécules d'image correspondent à celles d'une phase gazeuse; Dans l'eau, ils sont entourés de molécules d'eau, qui peuvent accepter l'ion hydrogène (faiblement) pour former les ions non2- et h3SOIT+.
Peut vous servir: BeakerSes structures peuvent adopter deux formes: cis ou trans, appelées isomères géométriques. Dans l'isomère cis, l'atome H est éclipsé avec l'atome d'oxygène voisin; Pendant que dans l'isomère trans, les deux se trouvent dans des positions antiopposites.
Dans l'isomère cis, la formation d'un hydrogène intramoléculaire (OH-No) est probable, qui peut importer l'intermoléculaire (onoh-onoh).
Propriétés
Noms chimiques
-Acide nitreux
-Acide dioxonitrique (III)
-Hydroxyde nitrosile
-Hydroxideoxidonitrogen (nom systématique IUPAC)
Description physique
Liquide bleu pâle, correspondant à la solution de nitrite.
Poids moléculaire
47 013 g / mol.
Constante de dissociation
C'est un acide faible. Son PKA est de 3,35 à 25 ºC.
Point de fusion
Est connu uniquement en solution. Par conséquent, votre point de fusion ne peut pas être calculé, et vos cristaux ne peuvent pas être isolés.
Point d'ébullition
Par pur non existant mais dans l'eau, les mesures de cette propriété ne sont pas précises. D'une part, cela dépend de la concentration du HNO2, Et de l'autre, son réchauffement produit sa décomposition. C'est pourquoi un point d'ébullition exact n'est pas signalé.
Formation des ventes
Nitrites solubles solubles avec Li+, N / A+, K+, CA2+, M2+, Ba2+. Mais, ne formez pas de sels avec des cations polyvalentes, telles que: à la3+ et / ou être2+ (en raison de sa densité de charge élevée). Il est capable de former des esters stables avec des alcools.
Potentiel d'incendie
Il est inflammable pour les réactions chimiques. Peut exploser par contact avec le trichlorure de phosphore.
Décomposition
C'est un composé très instable, et en solution aqueuse, il se décompose dans l'oxyde nitrique et l'acide nitrique:
2 HNO2 => Non2 + Non + H2SOIT
4 HNO2 => 2 hno3 + N2Ou + h2SOIT
Agent réducteur
L'acide nitreux en solution aqueuse est présenté sous forme d'ions nitrite, non2-, qui éprouvent plusieurs réactions de réduction.
Réagit avec les ions i- et la foi2+, sous forme de nitrite de potassium, pour former l'oxyde nitrique:
2 KNO2 + Ki + h2Swin4 => I2 + 2 Non +2 h2Ou + k2Swin2
Le nitrite de potassium en présence d'ions en étain est réduit pour former l'oxyde d'azote:
Kno2 + 6 HCL +2 SNCL2 => 2 sncl4 + N2O +3 H2O +2 kCl
Peut vous servir: hydroxyde de Beryl (être (oh) 2)Le nitrite de potassium est réduit par le Zn dans un environnement alcalin, formant l'ammoniac:
5 h2O + KNO2 + 3 Zn => NH3 + Koh +3 Zn (OH)2
Agent d'oxydation
En plus d'être un agent réducteur, l'acide nitreux peut intervenir dans les processus d'oxydation. Par exemple: oxyder en sulfure d'hydrogène, devenant de l'oxyde nitrique ou de l'ammoniac, en fonction de l'acidité du milieu dans lequel la réaction se produit.
2 HNO2 + H2S => S +2 NON +2 H2SOIT
HNO2 + 3 h2S => S + NH3 + 2 h2SOIT
L'acide nitreux, dans un milieu acide pH, peut oxyder l'ion d'iodure à l'iode.
HNO2 + Toi- + 6 h+ => 3 I2 + NH3 + 2 h2SOIT
Vous pouvez également agir comme un agent réducteur agissant sur Cu2+, provoquant l'acide nitrique.
Nomenclature
Au HNO2 Vous pouvez donner d'autres noms, qui dépendent du type de nomenclature. L'acide nictranable correspond à la nomenclature traditionnelle; acide dioxonitrique (III), à la nomenclature des stocks; et dioxonitrate (iii) d'hydrogène, à la systématique.
La synthèse
L'acide nitreux peut être synthétisé en dissolvant le trioxyde d'azote dans l'eau:
N2SOIT3 + H2O => 2 Hno2
Une autre méthode de préparation est la réaction du nitrite de sodium, nano3, avec des acides minéraux; comme l'acide chlorhydrique et l'acide bromhytérique. La réaction est faite à basse température et l'acide nitreux est consommé in situ.
Grand frère3 + H+ => Hno2 + N / A+
Le H+ Il vient de HCL ou HBR.
Des risques
Compte tenu de ses propriétés et caractéristiques chimiques, il y a peu d'informations sur les effets toxiques directs du HNO2. Peut-être que certains effets nocifs qui sont soupçonnés sont produits par ce composé, sont en fait causés par l'acide nitrique, qui peut se produire en décomposant l'acide nitreux.
Il est souligné que le HNO2 Il peut avoir des effets nocifs sur les voies respiratoires et être en mesure de produire des symptômes d'irritation chez les patients asthmatiques.
Sous forme de nitrite de sodium, il est réduit par la désoxyhémoglobine, produisant de l'oxyde nitrique. Il s'agit d'un vasodilatateur puissant qui produit une relaxation des muscles lisses vasculaires, estimant chez l'homme une dose LD50 de 35 mg / kg pour la consommation orale.
La toxicité de nitrite de sodium se manifeste avec un effondrement cardiovasculaire, suivie d'une hypotension sévère, due à l'action vasodilatatrice de l'oxyde nitrique, produite à partir de nitrite.
Dioxyde d'azote, non2, Présent dans l'air contaminé (smog), dans certaines conditions, il peut provoquer un acide nitreux; qui à son tour peut réagir avec les amines pour former de la nitrosamine, un gamma de composés cancérigènes.
Il peut vous servir: oxyde d'argent (AG2O)Une réaction similaire se produit avec la fumée de cigarettes. Des résidus de nitrosamine respectés à la doublure intérieure des véhicules fumeurs ont été trouvés.
Applications
Production de ventes de diazonium
L'acide nitreux est utilisé dans l'industrie dans la production de sels de diazonium, par sa réaction avec des amines aromatiques et des phénols.
HNO2 + Rnah2 + H+ => RNA = NAR + H2SOIT
Les sels de diazonium sont utilisés dans les réactions de synthèse organiques; Par exemple, dans la réaction de Sandmeyer. Dans cette réaction, le remplacement d'un groupe amino se produit (h2N-), dans une amine aromatique primaire, par les groupes CL-, BR- et CN-. Pour obtenir ces produits aromatiques, des salts de couple sont nécessaires.
Les sels de diazonium peuvent former des composés de toit brillants qui sont utilisés comme colorants et servent également de test qualitatif pour détecter la présence d'amines aromatiques.
Élimination de l'azida de sodium
L'acide nitreux est utilisé pour éliminer l'azide de sodium3), ce qui est potentiellement dangereux pour sa tendance à exploiter.
2 Nan3 + 2 HNO2 => 3 n2 + 2 Non +2 NaOH
Synthèse des oxymatiques
L'acide nitreux peut réagir avec les groupes de cétone pour former des oxys. Ceux-ci peuvent être oxydés pour former des carboxils ou de l'acide réduit pour provoquer l'amine.
Ce processus est utilisé dans la préparation commerciale de l'acide adipique, un monomère utilisé dans la production en nylon. Il intervient également dans la production de polyuréthane et ses esters sont des plastifiants, principalement dans le PVC.
Sous sa forme saline
L'acide nitreux, sous forme de nitrite de sodium, est utilisé dans le traitement et la conservation de la viande; Depuis, il empêche la croissance bactérienne et est capable de réagir avec la myoglobine, produisant une couleur rouge foncé qui rend la viande plus attrayante pour la consommation.
Ce même sel est utilisé, avec le thiosulfate de sodium, dans le traitement par voie intraveineuse de l'empoisonnement au cyanure de sodium.
Les références
- Graham Salomons t.W., Craig B. Fryhle. (2011). Chimie organique. Amines. (dixe Édition.). Wiley Plus.
- Fhiver & Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Se publier. (2019). Acide nitreux. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement
- Écoles de softs. (2019). Acide nitreux. Récupéré de: softschools.com
- Wikipédia. (2019). Acide nitreux. Récupéré de: dans.Wikipédia.org
- Société royale de chimie. (2015). Acide nitreux. Récupéré de: Chemspider.com
- Encyclopédie du Nouveau Monde. (2015). Acide nitreux. Récupéré de: newworldyclopedia.org
- Banc de drogue. (2019). Acide nitreux. Récupéré de: Drugbank.CA
- Formulation chimique. (2018). HNO2. Récupéré de: Formulation Quimica.com
- « Chiffres ou indicateurs qui parlent des avancées éducatives dans un pays
- Propriétés d'alkyl halogogenuros, obtention, exemples »

