Acide formique (HCOOH)
- 4825
- 78
- Prof Noah Collet
Nous expliquons ce qu'est l'acide formique, ses propriétés, sa structure et ses applications
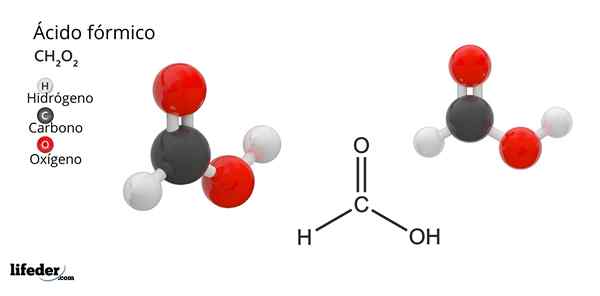
 Formule et structure de l'acide formique
Formule et structure de l'acide formique Qu'est-ce que l'acide formique?
Il acide formique ou acide méthaneC'est le composé le plus simple et le plus petit de tous les acides organiques. Il est également connu sous le nom d'acide de méthane et sa formule moléculaire est HCOOH, ayant juste un atome d'hydrogène lié à l'atome de carbone. Son nom dérive du mot formica, qui en latin signifie fourmi.
Les naturalistes du XVe siècle ont constaté que certains types d'insectes (les Formícidos), tels que les fourmis, les termites,. De plus, ces insectes utilisent l'acide formique comme mécanisme d'attaque, de défense et de signalisation chimique.
Ils ont des glandes toxiques qui excrètent ceci et d'autres acides (par exemple, l'acide acétique) comme une rosée à l'extérieur. L'acide formique est plus fort que l'acide acétique (ch3COOH); Par conséquent, dissous en quantités égales dans l'eau, l'acide formique produit des solutions avec des valeurs de pH inférieures.
Le naturaliste anglais John Ray a obtenu l'isolement de l'acide formique en 1671, le distichant à partir de grandes quantités de fourmis.
D'un autre côté, la première synthèse réussie de ce composé a été réalisée par le chimiste et physicien français Joseph Gay-Lussac, utilisant l'acide nocturne (HCN) comme réactif.
Où est l'acide formique?
 Les fourmis sécrètent l'acide formique
Les fourmis sécrètent l'acide formique L'acide formique peut être présent à des niveaux terrestres, en tant que composante de la biomasse ou dans l'atmosphère, impliquée dans un large spectre de réactions chimiques; Il peut même être trouvé sous les sols, à l'intérieur de l'huile ou en phase gazeuse à sa surface.
En termes de biomasse, les insectes et les plantes sont les principaux générateurs de cet acide. Lorsque les combustibles fossiles sont brûlés, produisez de l'acide formique gazeux; Par conséquent, les moteurs de véhicules libèrent de l'acide formique à l'atmosphère.
Cependant, la Terre héberge un nombre exorbitant de fourmis, et parmi tous ceux-ci sont capables de produire en un an des milliers de fois la quantité d'acide formique généré par l'industrie humaine. De plus, les incendies de forêt représentent des sources gazeuses d'acide formique.
Il peut vous servir: lithium: histoire, structure, propriétés, risques et utilisationsCi-dessus, dans la matrice atmosphérique complexe, des processus photochimiques se produisent qui synthétisent l'acide formique.
À ce stade, de nombreux composés organiques volatils (COV) sont dégradés sous les effets du rayonnement ultraviolet, ou sont oxydés par des mécanismes de radicaux libres OH. La chimie atmosphérique riche et complexe est, de loin, la source prédominante d'acide formel formel.
Structure acide formique
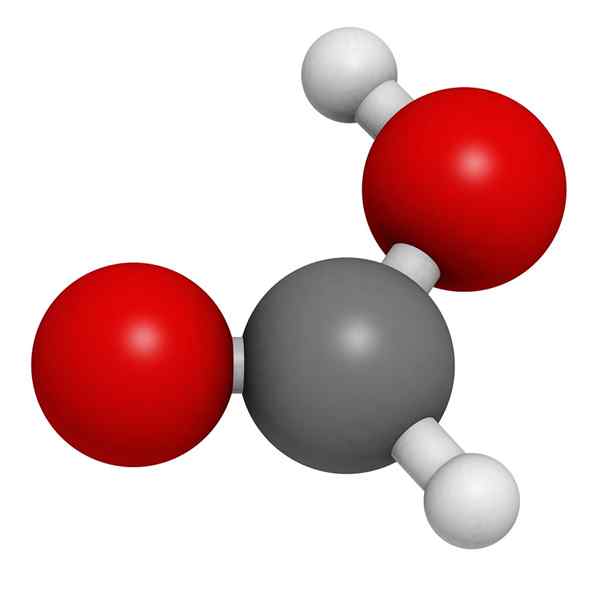 Modèle moléculaire d'acide formique
Modèle moléculaire d'acide formique Dans l'image supérieure, la structure d'une phase gazeuse de l'acide formique est illustrée. Les sphères blanches correspondent aux atomes d'hydrogène, à l'oxygène rouge et aux atomes noirs aux atomes de carbone.
Dans ces molécules, deux groupes peuvent être appréciés: hydroxyle (-oh) et formil (-ch = o), tous deux capables de former des ponts d'hydrogène.
Ces interactions sont de type O-H-O, étant les groupes hydroxils les donneurs de la H et les groupes formimilent les donneurs de l'OR.
Cependant, H lié à l'atome de carbone n'a pas cette capacité. Ces interactions sont très fortes et, en raison de l'atome de H pauvre dans les électrons, l'hydrogène du groupe OH est plus acide; Par conséquent, cet hydrogène stabilise davantage les ponts.
À la suite de ce qui précède, l'acide formique existe sous une forme de boulon et non comme une molécule individuelle.
Structure cristalline
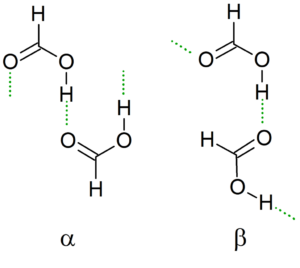
Au fur et à mesure que la température descend, le dimère guide ses ponts d'hydrogène pour générer la structure la plus stable possible avec les autres dimères, créant ainsi des chaînes infinies α et β de l'acide formique.
Une autre nomenclature est les conformères "cis" et "trans". Dans ce cas, "CIS" est utilisé pour désigner des groupes orientés dans la même direction, et "trans" pour ces groupes en contraire.
Peut vous servir: tanteo équilibre: étapes, exemples et exercicesPar exemple, dans la chaîne α, les groupes formiles "pointent" du même côté (la gauche), contrairement à la chaîne β, où ces groupes de formyle pointent vers des côtés opposés (image supérieure).
Cette structure cristalline dépend des variables physiques qui agissent dessus, comme la pression et la température. Ainsi, les chaînes sont convertibles; Autrement dit, dans des conditions différentes, une chaîne «cis» peut être transformée en une chaîne «trans», et vice versa.
Si les pressions augmentent à des niveaux drastiques, les chaînes sont suffisamment comprimées pour être considérées comme un polymère cristallin d'acide formique.
Propriétés d'acide formique
Les propriétés physiques et chimiques de l'acide formique sont mentionnées ci-dessous:
- L'acide formique est un liquide à température ambiante, incolore et avec une odeur forte et pénétrante. Il a un poids moléculaire de 46 g / mol, il fond à 8,4 ° C et a un point d'ébullition de 100,8 ºC, supérieur à celui de l'eau.
- Il est miscible dans l'eau et les solvants organiques polaires, comme l'éther, l'acétone, le méthanol et l'éthanol.
- D'un autre côté, dans des solvants aromatiques (comme le benzène et le toluène), il est légèrement soluble, car l'acide formique a à peine un atome de carbone dans sa structure.
- Il a une PKA de 3,77, plus d'acide que celle de l'acide acétique, qui peut être expliquée car le groupe méthyle fournit une densité électronique à l'atome de carbone oxydé par les deux oxygène. Il en résulte une légère descente dans l'acidité du proton (ch3COOH, HCOOH).
- Notoubé l'acide, cela devient le format Anion HCOO-, qui peut décorer la charge négative entre les deux atomes d'oxygène. Par conséquent, c'est un anion stable et explique la grande acidité de l'acide formique.
Réactions
L'acide formique peut être déshydraté dans le monoxyde de carbone (CO) et l'eau. En présence de catalyseurs en platine, il peut également se décomposer dans l'hydrogène moléculaire et le dioxyde de carbone:
HCOOH (L) → H2(g) + CO2(g)
Cette propriété permet à l'acide formique d'être considéré comme un moyen sûr de stocker l'hydrogène.
Utilisations / applications d'acide formique
L'industrie alimentaire et agricole
Malgré la façon dont l'acide formique peut être nocif, il est utilisé à des concentrations adéquates comme conservateur dans la nourriture en raison de son action antibactérienne. Pour la même raison, il est utilisé dans l'agriculture, où il a également une action de pesticide.
Il présente également une action de conservation sur les pâturages, ce qui aide à prévenir les gaz intestinaux chez les animaux reproducteurs.
L'industrie du textile et des chaussures
Il est utilisé dans l'industrie textile dans la coloration et le raffinement des textiles, peut-être l'utilisation la plus fréquente de cet acide.
L'acide formique est utilisé dans le traitement du cuir en raison de sa misérable action et de l'élimination des cheveux de ce matériau.
Sécurité routière sur les routes
En plus des utilisations industrielles indiquées, celles dérivées de l'acide de format (formats) sont utilisées en Suisse et en Autriche sur les routes pendant l'hiver, afin de réduire le risque d'accidents. Ce traitement est plus efficace que l'utilisation de sel commun.
Les références
- Tellus (1988). Formique atmosphérique des fourmis formicines: une évaluation préliminaire408, 335-339.
- B. Millet et al. (2015). Sources et puits d'acide formique atmosphérique. Atmosphère. Chem. Chèque., 15, 6283-6304.
- Wikipédia. (2018). ACIDE FORMIQUE. Récupéré de.Wikipédia.org
- Actif. ACIDE FORMIQUE. Récupéré de Agipedia.org
- Docteur. N. K. Rotuler. MODURE: 2, Conférence: 7. ACIDE FORMIQUE. Nptel a récupéré.CA.dans
- Jean et Fred. (14 juin 2017). Quitter les termites des monticules. [Chiffre]. Récupéré de: flickr.com

