Acide fluorhorique (HF)
- 2450
- 198
- Paul Dumas
Qu'est-ce que l'acide fluorhorique?
Il acide hydrofluorique (Hf)C'est une solution aqueuse dans laquelle le fluorure d'hydrogène est dissous. Cet acide est principalement obtenu à partir de la réaction de l'acide sulfurique concentré avec du minéral de fluorite (CAF2). Le minéral est dégradé par l'action de l'acide restant et l'eau dissout les gaz de fluorure d'hydrogène.
De cette même eau acide, le produit pur peut être distillé, c'est-à-dire un fluorure d'hydrogène anhydride. Selon les quantités de gaz dissous, différentes concentrations sont obtenues et, par conséquent, plusieurs produits disponibles d'acide fluorhorhorique sur le marché.
À une concentration inférieure à 40%, il a une apparence cristalline indiscernable de l'eau, mais à des concentrations plus élevées, il se dit au revoir aux vapeurs de fluorure d'hydrogène blanc. L'acide fluorhorique est connu comme l'un des produits chimiques les plus agressifs et les plus dangereux.
Il est capable de "manger" presque tous les matériaux avec lesquels vous avez un contact: du verre, de la céramique et des métaux aux rochers et au béton. Dans quel conteneur est ensuite stocké? Dans des bouteilles en plastique, des polymères synthétiques inertes à votre action.
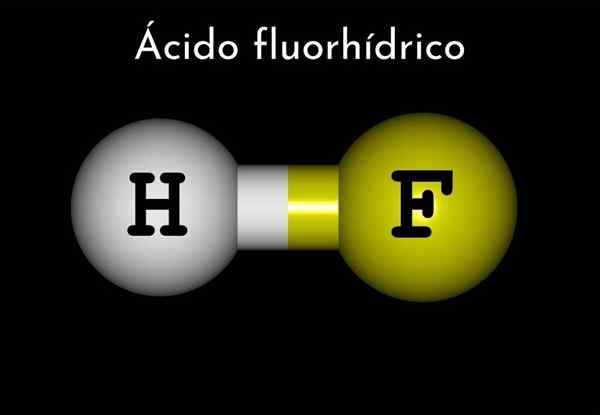
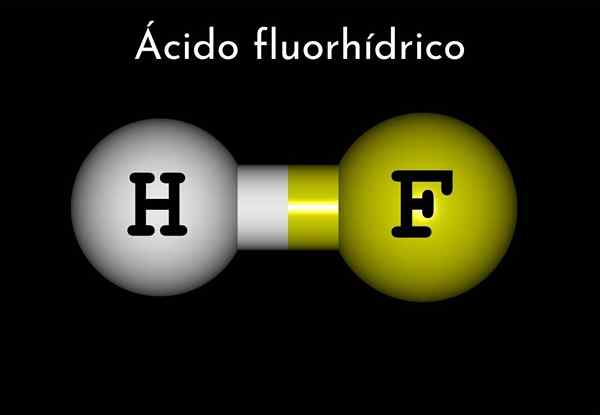
Formule
La formule du fluorure d'hydrogène est HF, mais celle de l'acide fluorhorique est représentée dans un milieu aqueux, HF (AC), pour se différencier du premier.
Ainsi, l'acide fluorhorique peut être considéré comme un fluorure d'hydrogène hydraté, et c'est de l'anhydride.
Structure de acide hydrofluorique
 Modèle 3D d'acide fluorhydrique
Modèle 3D d'acide fluorhydrique Tout l'acide dans l'eau a la capacité de générer des ions dans une réaction d'équilibre. Dans le cas de l'acide du fluor, on estime que dans une solution, il y a la paire d'hons H3SOIT+ et f-.
Anion f- Forment probablement un pont d'hydrogène très fort avec l'un des hydrogènes cationaux (F-H-O+-H2). Cela explique pourquoi l'acide fluorhorhorique est un acide Bree faible (donneur de protons, H+), malgré sa réactivité élevée et dangereuse; c'est-à-dire que dans l'eau ne libère pas autant de h+ par rapport à d'autres acides (HCL, HBR ou HI).
Il peut vous servir: combien d'électrons de garde?Cependant, dans les interactions concentrées sur l'acide fluorhorhorique entre les molécules de fluorure d'hydrogène, sont suffisamment efficaces pour leur permettre de s'échapper en phase gazeuse.
C'est-à-dire dans l'eau, ils peuvent interagir comme s'ils se trouvaient dans l'anhydride liquide, formant ainsi des ponts d'hydrogène entre ceux-ci. Ces ponts d'hydrogène peuvent être assimilés sous forme de chaînes presque linéaires (h-f-h-f-h-f-…) entourées d'eau.

Dans l'image supérieure, le couple non partagé d'électrons orienté dans la direction opposée du lien (H-F :) interagit avec une autre molécule HF pour assembler la chaîne.
Propriétés de acide hydrofluorique
Parce que c'est l'acide fluorhorhorique une solution aqueuse, ses propriétés dépendent de la concentration d'anhydride dissoute dans l'eau. Le HF est très soluble dans l'eau et est hygroscopique, pouvant produire une variété de solutions: de très concentré (fumer et avec des tons jaunes) à très dilué.
À mesure que sa concentration diminue, HF (AC) adopte les propriétés plus similaires à l'eau pure que l'anhydride. Cependant, les ponts d'hydrogène H-F-H sont plus forts que ceux de l'eau, H2Oh oh.
Les deux coexistent en harmonie dans les solutions, augmentant les points d'ébullition (jusqu'à 105 ° C). De même, les densités augmentent à mesure que plus d'hinhydride est dissous. Du reste, toutes les solutions HF (AC) ont des odeurs solides et irritantes et sont incolores.
Réactivité
Alors, quel est le comportement corrosif de l'acide fluorhorique? La réponse est dans la liaison H-F et dans la capacité de l'atome de fluor de former des liens covalents très stables.
Comme le fluorure est un atome très petit et électronégatif, c'est un puissant acide Lewis. C'est-à-dire qu'il se sépare de l'hydrogène pour lier les espèces qui offrent plus d'électrons à un coût à faible énergie. Par exemple, ces espèces peuvent être des métaux, comme le silicium présent dans le verre.
Il peut vous servir: chimie nucléaire: histoire, domaine d'étude, zones, applicationsSio2 + 4 HF → SIF4(g) + 2 h2SOIT
Sio2 + 6 HF → H2Sif6 + 2 h2SOIT
Si l'énergie de dissociation de la liaison H-F est élevée (574 kJ / mol), pourquoi est-elle brisée dans les réactions? La réponse a des nuances cinétiques, structurelles et énergétiques. En général, moins le produit résultant est réactif, plus sa formation est favorisée.
Qu'arrive-t-il à f- dans l'eau? Dans les solutions concentrées d'acide fluorhorique, une autre molécule HF peut former un pont d'hydrogène avec le F- de la paire [h3SOIT+F-]].
Il en résulte la génération de l'ion de défluorure [FHF]-, qui est extraordinairement acide. C'est pourquoi tout contact physique avec cela est extrêmement nocif. La moindre exposition peut déclencher une infinité de dommages à l'agence.
Il existe de nombreuses normes de sécurité et protocoles pour une gestion adéquate, et évitez ainsi des accidents potentiels à ceux qui fonctionnent avec cet acide.
Utilisations / applications de l'acide fluorhorhorique
C'est un composé avec de nombreuses applications dans l'industrie, dans la recherche et dans le travail des consommateurs:
- L'acide fluorhorique génère des dérivés organiques impliqués dans le processus de purification en aluminium.
- Il est utilisé dans la séparation des isotopes d'uranium, comme dans le cas de l'hexafluoruro d'uranium (UF6). Il est également utilisé dans l'extraction, la transformation et le raffinage des métaux, des roches et des huiles, également utilisés pour l'inhibition de la croissance et de l'élimination du moule du moule.
- Des propriétés d'acide corrosives ont été utilisées pour sculpter et enregistrer des cristaux, en particulier glaciaux, à travers la technique de la gravure.
- Il est utilisé dans la fabrication de semi-conducteurs en silicone, avec de multiples utilisations dans le développement de l'informatique et de l'informatique, responsable du développement humain.
- Il est utilisé dans l'industrie automobile comme nettoyeur, utilisé comme dissolvant de moisissure en céramique.
- En plus de servir d'intermédiaire dans certaines réactions chimiques, l'acide fluorhorique est utilisé dans certains échangeurs d'ions impliqués dans la purification de métaux et de substances plus complexes.
- Participer au traitement de l'huile et à ses dérivés, ce qui a permis l'obtention de solvants à utiliser dans la fabrication de produits pour le nettoyage et l'élimination des graisses.
- Il est utilisé dans la génération d'agents pour le placage et le traitement de surface.
- Les consommateurs utilisent de nombreux produits dans lesquels l'acide fluorhorique a participé à son élaboration; Par exemple, certains nécessaires pour les soins de voiture, les produits de nettoyage pour les meubles, les composants électriques et électroniques et les carburants, entre autres produits.
Les références
- Se publier. (2018). Acide hydrofluorique. Récupéré le 3 avril 2018 de: PubChem.NCBI.NLM.NIH.Gouvernement.
- Jour de Kat. (16 avril 2013). L'acide qui mange vraiment à travers tout. Récupéré le 3 avril 2018 de: Chronicleflask.com
- Wikipédia. (28 mars 2018). Acide hydrofluorique. Récupéré le 3 avril 2018 de: dans.Wikipédia.org.
- Fhiver & Atkins. (2008). Chimie inorganique. (quatrième édition., p. 129, 207-249, 349, 407). Mc Graw Hill.
- Acide hydrofluorique. Muscade. Université médicale de Caroline du Sud. Récupéré le 3 avril 2018 de: AcademicDepartments.Muscade.Édu