Acide carboxylique
- 2825
- 451
- Adrien Remy
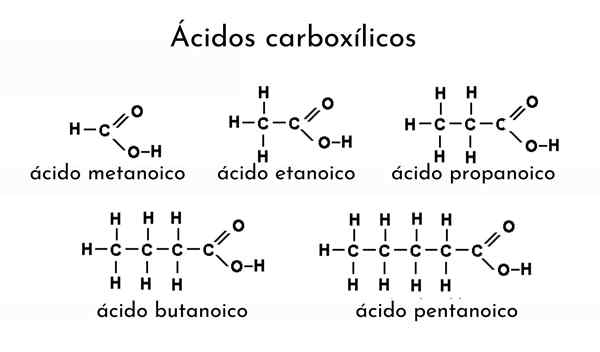
 Exemples d'acides carboxyliques
Exemples d'acides carboxyliques Que sont les acides carboxyliques?
Il acide carboxylique C'est un terme attribué à tout composé organique contenant un groupe carboxyle. Ils peuvent également être appelés acides biologiques et sont présents dans de nombreuses sources naturelles. Par exemple, à partir de fourmis et d'autres insectes tels que la galette de coléoptère, l'acide formique, un acide carboxylique est distillé.
C'est-à-dire qu'une fourmile est une source riche en acide formique. De plus, l'acide acétique est extrait du vinaigre, l'odeur du beurre ranique est due à l'acide butyrique, les herbes de la valeria contiennent de l'acide cérébral et des capuchons obtenus d'acide caprique, tous ces acides carboxyliques.
L'acide lactique donne le mauvais goût du lait aigre, et dans certaines graisses et huiles, les acides gras sont présents. Les exemples de sources naturelles d'acides carboxyliques sont innombrables, mais tous leurs noms attribués sont dérivés de mots en latin. Ainsi, en latin le mot formica signifie "fourmi".
Comme ces acides étaient extraits dans différents chapitres de l'histoire, ces noms étaient courants, se consolidant dans la culture populaire.
Formule
La La formule générale de l'acide carboxylique est -r -coh, ou plus de détails: R- (c = o) -oh. L'atome de carbone est lié à deux atomes d'oxygène, ce qui entraîne une diminution de sa densité électronique et, par conséquent, une charge partielle positive.
Cette charge reflète le statut d'oxydation du carbone dans un composé organique. Dans tout autre, le carbone est aussi rouillé que dans le cas des acides carboxyliques, cette oxydation étant proportionnelle au degré de réactivité du composé étant.
Pour cette raison, le groupe -coooh a une prédominance contre d'autres groupes organiques et définit la nature carbonatée principale et la principale chaîne gazéifiée du composé.
Par conséquent, il n'y a pas de dérivés acides d'amines (R-NH2), mais les aminos dérivés d'acides carboxyliques (acides aminés).
Nomenclature
Les noms communs dérivés du latin pour les acides carboxyliques ne clarifient pas la structure du composé, ni leur arrangement ou leur disposition de leurs groupes d'atomes.
Étant donné la nécessité de ces clarifications, la nomenclature systématique de l'IUPAC se produit pour nommer des acides carboxyliques.
Peut vous servir: Bromine: historique, structure, configuration électronique, propriétés, utilisationsCette nomenclature est régie par plusieurs règles, et certaines d'entre elles sont:
Règle 1
Pour mentionner un acide carboxylique, le nom de son alcane doit être modifié en ajoutant le suffixe «ICO». Ainsi, pour l'éthane (choisissez3-Ch3) Son acide carboxylique correspondant est l'acide éthanoïque (ch3-COOH, acide acétique, le même de vinaigre).
Un autre exemple: pour Cho3Ch2Ch2-COOH El Alcano devient butane (ch3Ch2Ch2Ch3) et, par conséquent, l'acide butanoïque (l'acide butyrique, le même de beurre rancée) est nommé.
Règle 2
Le groupe -coooh définit la chaîne principale, et le nombre correspondant à chaque carbone est compté à partir de carbonyle.
Par exemple, Cho3Ch2Ch2Ch2-COOH est l'acide pentanoïque, comptant d'un à cinq carbones au méthyle (choisissez3). Si un autre groupe méthyle est lié au troisième carbone, ce serait Cho3Ch2Ch (ch3) Ch2-COOH, étant la nomenclature qui en résulte maintenant: l'acide 3-méthylpentanoïque.
Règle 3
Les substituants sont précédés du nombre du carbone auquel ils sont liés. De même, ces substituants peuvent être des liens doubles ou triples et ajouter le suffixe «ICO» également aux alcènes et aux alkines. Par exemple, Cho3Ch2Ch2Ch = chch2-COOH est mentionné comme acide (cis ou trans) 3- heptenoïque.
Règle 4
Lorsque la chaîne R se compose d'un anneau (φ). L'acide est mentionné en commençant par le nom de l'anneau et se terminant par le suffixe "carboxylique". Par exemple, le φ-COOH est nommé d'acide benzénocarboxylique.
Structure d'acide carboxylique
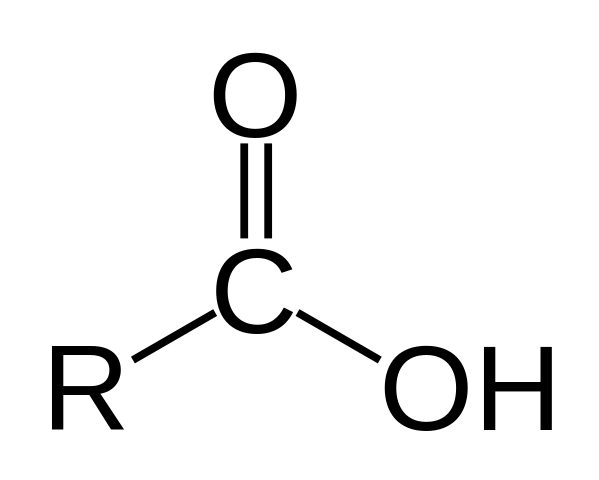 Structure d'un acide carboxylique. R est une chaîne d'hydrogène ou de gazé.
Structure d'un acide carboxylique. R est une chaîne d'hydrogène ou de gazé. Dans l'image supérieure, la structure générale de l'acide carboxylique est représentée. La chaîne latérale R peut avoir n'importe quelle longueur ou posséder toutes sortes de substituants.
L'atome de carbone a une hybridation SP2, ce qui vous permet d'accepter une double liaison et de générer des angles de liaison d'environ 120 °.
Par conséquent, ce groupe peut être assimilé comme un triangle plat. L'oxygène supérieur est riche en électrons, tandis que l'hydrogène inférieur est pauvre en électrons, devenant un hydrogène acide (accepteur d'électrons). Ceci est observable dans les structures de résonance à double liaison.
L'hydrogène est affecté à une base, et pour cette raison cette structure correspond à un composé acide.
Peut vous servir: aminesPropriétés de l'acide carboxylique
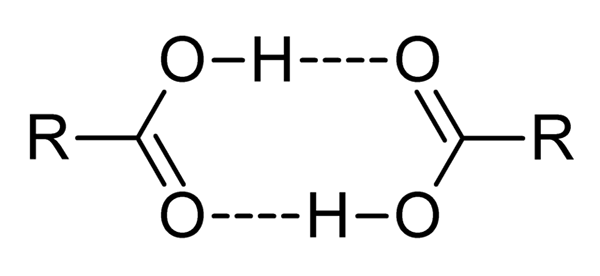
Les acides carboxyliques sont des composés très polaires, des odeurs intenses et avec la facilité d'interagir efficacement les uns avec les autres par des ponts d'hydrogène, comme illustré par l'image supérieure.
Lorsque deux acides carboxyliques interagissent de cette manière, les dímeros sont formés, certains suffisamment stables pour exister en phase gazeuse.
Les ponts d'hydrogène et de diamètre font que les acides carboxyliques ont des points d'ébullition plus élevés que l'eau. En effet.
Les petits acides carboxyliques ont une grande affinité pour l'eau et les solvants polaires. Cependant, lorsque le nombre d'atomes de carbone est supérieur à quatre, le caractère hydrophobe des chaînes R prédomine et devient non miscible avec l'eau.
En phase solide ou liquide, la longueur de la chaîne R et les substituants qu'elle possèdent jouent un rôle important. Ainsi, lorsque les chaînes sont très longues, ils interagissent les uns avec les autres à travers les forces de dispersion de Londres, comme dans le cas des acides gras.
Acidité
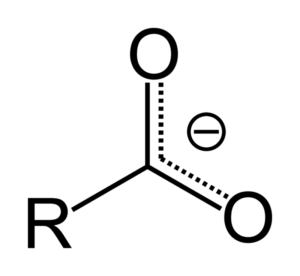
Lorsque l'acide carboxylique donne un proton, il devient l'anion carboxylate, représenté dans l'image supérieure. Dans cet anion, la charge négative est déplacée entre les deux atomes de carbone, le stabilisant et, par conséquent, favorisant la réaction à se produire.
Comment varie cette acidité d'un acide carboxylique à un autre? Tout dépend de l'acidité du proton dans le groupe OH: le plus pauvre en électrons, plus.
Cette acidité peut être augmentée si l'un des substituants de la chaîne RA est une espèce électronégative (qui attire ou retire la densité électronique de son environnement).
Par exemple, si dans Cho3-COOH est remplacé A H du groupe méthyle par un atome de fluor (CFH2-COOH) L'acidité augmente considérablement parce que F retire la densité électronique du carbonyle, de l'oxygène, puis de l'hydrogène. Si tous H sont remplacés par F (cf3-COOH) L'acidité atteint sa valeur maximale.
Peut vous servir: hydrogène: histoire, structure, propriétés et utilisationsQuelle variable détermine le degré d'acidité? Le pkpour. Plus le PK est baspour Et plus près de 1, la capacité de l'acide est plus grande à se dissocier dans l'eau et, à son tour, plus dangereuse et nocive. À partir de l'exemple précédent, cf3-COOH a la valeur PK la plus bassepour.
Utilisations / applications des acides carboxyliques
En raison de l'immense variété d'acides carboxyliques, chacun d'eux a une application potentielle dans l'industrie, que ce soit des polymères, des produits pharmaceutiques ou des aliments.
Industrie alimentaire
- Additifs.
- Conservateurs (acide sorbique et acide benzoïque).
- Régulateur d'alcalinité de nombreux produits.
- Production de boissons gazeuses.
- Agents antimicrobiens avant l'action des antioxydants. Dans ce cas, la tendance est un antimicrobien liquide.
- Ingrédient principal du vinaigre commun (acide acétique).
- Acidulant dans les boissons gazeuses et les aliments (acide citrique et acide lactique).
- Assistant dans la maturation du fromage suisse (acide propionique).
- Fromage, chucrut, colm fermenté et boissons gazeuses (acide lactique).
Industrie pharmaceutique
- Antipyrétique et analgésique (acide acétylsalicylique).
- Actif dans le processus de synthèse d'arôme, dans certains médicaments (acide butyrique ou butanoïque).
- Antimicotique (acide benzoïque combiné à l'acide salicylique).
- Actif pour la fabrication de médicaments en vitamine C (acide ascorbique).
- Fongicide (acide caprilique).
- Fabrication de certains laxatifs (acide hydroxybothanodium).
Autres industries
- Fabrication de plastiques et de lubrifiants (acide sorbique).
- Fabrication de vernis, de résines élastiques et d'adhésifs transparents (acide acrylique).
- Fabrication de peintures et de vernis (acide linoléique).
- Fabrication de savons, de détergents, de shampooings, de cosmétiques et de produits de nettoyage en métal (acide oléique).
- Fabrication de pâtes dentaires (acide salicylique).
- Production d'acétate de rayonne, films photographiques et solvants pour peintures (acide acétique).
- Dye et production bronzée (acide méthane).
- Préparation d'huiles de lubrifiant, de matériaux étanches et de peintures sécantes (acide palmitique).
- Fabrication en caoutchouc (acide acétique).
- Élaboration en caoutchouc et galvanoplastie.
- Solvant.
- Production de parfum (acide benzoïque).
- Fabrication de plastifiants et de résines (acide photographique).
- Élaboration en polyester (acide téréftallique).
- Préparation des bougies de paraffine (acide stéarique).
Les références
- Graham Salomons t.W., Craig B. Fryhle. Chimie organique. Acides carboxyliques et leurs dérivés (10e édition., page 779-783). Wiley Plus.
- Acides organiques. Naturalwellbeing récupéré.com
- Francis a. Écaille de tortue. Chimie organique. Acides carboxyliques. (Sixième édition., Page 805-820). Mc Graw Hill.
- William Reusch. Acides carboxyliques. Récupéré de la chimie.MSU.Édu
- « Caractéristiques et facteurs de risque de biodiversité au Mexique
- Les 5 branches de la biotechnologie principale »

