Acide benzoïque (C6H5COOH)
- 4577
- 788
- Adam Mercier
 L'acide benzoïque est un acide carboxylique aromatique
L'acide benzoïque est un acide carboxylique aromatique Qu'est-ce que l'acide benzoïque?
Il Acide benzoique C'est l'acide aromatique le plus simple de tous, ayant comme formule moléculaire C6H5COOH. Dans la nature, il se trouve dans de nombreuses plantes, en particulier dans les fruits tels que l'abricot et les myrtilles. Il se produit également dans les bactéries comme sous-produit du métabolisme de la phénylalanine aux acides aminés.
Il est généré dans l'intestin par la transformation bactérienne (oxydative) des polyphénols présents dans certains aliments.
Le C6H5COOH est, contrairement à de nombreux acides, un composé solide, composé de cristaux légers, blancs et filiformes, qui dégagent un arôme d'amande et caractéristique.
L'une des principales capacités de l'acide benzoïque est d'inhiber la croissance de la levure, de la moisissure et de certaines bactéries, il est donc utilisé comme conservateur alimentaire.
Bien que ce ne soit pas un composé particulièrement toxique, il a des actions nocives pour la santé. Par conséquent, qui recommande une dose d'admission maximale de 5 mg / kg de poids corporel / jour, équivalent à un apport quotidien de 300 mg d'acide benzoïque.
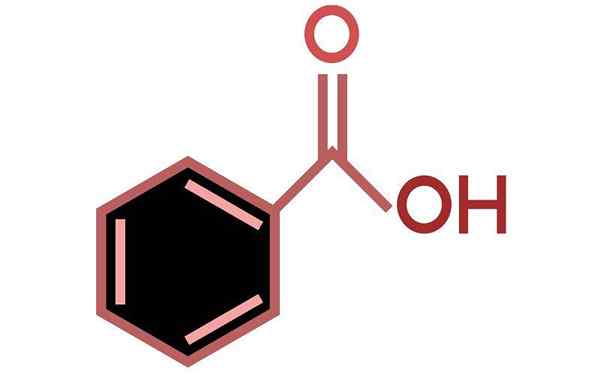
Structure d'acide benzoïque
 Structure d'acide benzoïque. Source: Wikimedia Commons
Structure d'acide benzoïque. Source: Wikimedia Commons L'image supérieure représente la structure de l'acide benzoïque dans une barre et des sphères.
Si le nombre de sphères noires est comptée, il sera vérifié qu'il y en a six, c'est-à-dire six atomes de carbone, deux sphères rouges correspondent aux deux atomes d'oxygène du groupe carboxyle, -COOH, et enfin, les sphères blanches sont les atomes d'hydrogène.
À gauche, vous avez l'anneau aromatique, dont l'aromaticité est illustrée avec les lignes discontinues au centre de l'anneau. Et à droite, le groupe -cooh, responsable des propriétés acides de ce composé.
Moléculairement, le C6H5COOH a une structure plate, car tous ses atomes (à l'exception des hydrogènes) ont une hybridation SP2.
D'un autre côté, le groupe -cooh, très polaire, permet à un dipôle permanent d'exister dans la structure.
Ce fait entraîne le C6H5Cooh peut interagir avec lui-même à travers les forces dipol-dipolo. Plus précisément, avec des ponts d'hydrogène spéciaux.
Si le groupe -COOH est observé, il sera constaté que l'oxygène du C = O peut accepter un pont d'hydrogène, tandis que l'oxygène O -H les donne.
Ponts de cristal et d'hydrogène
L'acide benzoïque peut former deux ponts d'hydrogène: reçoit et en accepte un simultanément. Par conséquent, il forme des dímeros, c'est-à-dire que sa molécule est «liée» à un autre.
Ce sont des paires ou des dimères, c6H5COOH-HOOCC6H5, la base structurelle qui définit le solide résultant de sa planification dans l'espace.
Peut vous servir: éléments diatomiquesPropriétés physiques et chimiques de l'acide benzoïque
Noms chimiques
Acide:
-benzoïque
-benzénocarboxylique
-Dracyle
-Carboxibenzène
-benzénophorémique
Formule moléculaire
C7H6SOIT2 ou c6H5COOH
Poids moléculaire
122 123 g / mol.
Description physique
Solide ou sous forme de cristaux, généralement blanc, mais peut présenter une couleur beige si elle abrite certaines impuretés. Ses cristaux sont en forme de schéma ou d'aiguille.
Odeur
Ça sent les amandes et c'est bon.
Saveur
Insipide ou légèrement amer. La limite de détection des saveurs est de 85 ppm.
Point d'ébullition
480º F a 760 mmHg (249 ºC).
Point de fusion
252.3º F (121,5-123,5 ºC).
point d'allumage
250º F (121 ºC).
Sublimation
Peut sublimer à partir du 100 ºC.
Solubilité dans l'eau
3,4 g / L A 25 ºC.
Solubilité dans les solvants organiques
- 1 g d'acide benzoïque se dissout dans un volume égal à: 2,3 ml d'alcool froid, 4,5 ml de chloroforme, 3 ml d'éther, 3 ml d'acétone, 30 ml de tétrachlorure de carbone, 10 ml de benzène, 30 ml de disulfure de carbone, et 2,3 ml d'huile de Treem.
- Il est également soluble dans les huiles volatiles et fixes.
- Il est légèrement soluble dans l'éther d'huile.
- Sa solubilité en hexano est de 0,9 g / L, en méthanol 71,5 g / L, et en toluène 10,6 g / L.
Densité
1 316 g / ml à 82,4 ° F et 1 2659 g / ml à 15 ° C.
Densité de vapeur
4,21 (avec la relation aérienne prise comme référence = 1)
La pression de vapeur
1 mmHg à 205 ° F et 7,0 x 10-4 mmhg à 25 ºC.
La stabilité
Une solution avec une concentration de 0,1% dans l'eau est stable pendant au moins 8 semaines.
Décomposition
Il se décompose en réchauffant, en émettant un acre et en fumée irritante.
Gelée
1,26 cpoise à 130 ºC.
Chaleur de combustion
3227 kJ / mol.
Chaleur de vaporisation
534 kJ / mol à 249 ºC.
pH
Environ 4 dans l'eau.
Tension superficielle
31 N / m A 130 ºC.
Pka
4.19 à 25 ºC.
Indice de réfraction
1 504-1,5397 (ηd) à 20 ºC.
Réactions
- En contact avec les bases (naoh, koh, etc.) Former les ventes de benzoat. Par exemple, si vous réagissez avec le NaOH, forme de benzoate de sodium, C6H5Chemin.
- Réagit avec les alcools pour former des esters. Par exemple, sa réaction à l'alcool éthylique provient de l'ester éthylique. Certains esters d'acide benzoïque remplissent fonctionnent comme des plastifiants.
- Réagit avec le pentachlorure de phosphore, PCL5, Pour former le chlorure de Benzoil, un halogénure acide. Le chlorure de benzoi peut réagir avec l'ammonium (NH3) ou une amine comme la méthylamine (CHO3NH2) Pour former du benzamide.
- La réaction de l'acide benzoïque avec de l'acide sulfurique produit une sulfonation de l'anneau aromatique. Le groupe fonctionnel -So3H remplace un atome d'hydrogène dans la position cible de l'anneau.
Il peut vous servir: Première révolution de la chimie- Il peut réagir avec l'acide nitrique, avec l'utilisation d'acide sulfurique comme catalyseur, formant l'acide méta-nitrobenzoïque.
- En présence d'un catalyseur, comme le chlorure ferrique, FECL3, L'acide benzoïque réagit avec les halogènes. Par exemple, il réagit avec le chlore pour la formation d'acide méta-chlorobenzoïque.
Production
Quelques méthodes de production de ce composé:
- La plupart de l'acide benzoïque se produit industriellement en oxydant du toluène avec l'oxygène présent dans l'air. Le processus est catalysé par l'essence en cobalt, à une température de 140-160 ºC et à une pression de 0,2-0,3 MPa.
- Le toluène peut chlorer pour produire du benzotriclorure, qui est par la suite hydrolysé d'acide benzoïque.
- L'hydrolyse benzonitrile et benzamide, dans un milieu acide ou alcalin, peut provoquer l'acide benzoïque et ses bases conjuguées.
- L'alcool benzylique dans une oxydation médiée par le permanganate de potassium, dans un milieu aqueux, produit de l'acide benzoïque. La réaction se produit par chauffage ou distillation de reflux. Une fois le processus terminé, le mélange est filtré pour éliminer le dioxyde de manganèse, tandis que le surnageant est refroidi pour obtenir de l'acide benzoïque.
- Le composé de benzocticorure réagit avec l'hydroxyde de calcium, en utilisant des sels de fer ou de fer comme catalyseurs, formant initialement le benzoate de calcium, CA (C (C6H5Roucouler)2. Ensuite, ce sel, par réaction avec de l'acide chlorhydrique, est converti en acide benzoïque.
Utilisation de l'acide benzoïque
Industriels
- Il est utilisé dans la production de phénol par décarboxylation oxydative de l'acide benzoïque à des températures de 300-400 ºC, car le phénol peut être utilisé dans la synthèse du nylon.
- De lui le benzoate glycol, précurseur chimique de l'ester diéthylène glycol et de l'ester triéthylène glycol, substances utilisées comme plastifiants. L'application la plus importante de plastifiants est peut-être les formulations adhésives. Certains esters à longue chaîne sont utilisés pour adoucir les plastiques tels que le PVC.
- Il est utilisé comme activateur de la polymérisation en caoutchouc. De plus, il s'agit d'un intermédiaire dans la fabrication de résines alquidiques, ainsi que d'additifs pour des applications dans la récupération du pétrole brut.
- De plus, il est utilisé dans l'élaboration des résines, des colorants, des fibres, des pesticides et comme agent modifiant de la résine polyamide pour la production de polyester. Il est utilisé pour l'entretien des arômes du tabac.
Peut vous servir: sels binaires- C'est un précurseur du chlorure de Benzoil, qui est un matériau de départ pour la synthèse de composés tels que le benzoate de benzyle, utilisé dans l'élaboration des saveurs artificielles et des insectes d'insectes.
Médicinal
- C'est un composant de la poitrine de Whitfield. Cette pommade est composée de 6% d'acide benzoïque et de 3% d'acide salicylique.
- Il s'agit d'un ingrédient de la teinture de benzoine, utilisé comme inhalant un topique et un antiseptique décongestionnants. Il a été utilisé comme expectorant, analgésique et antiseptique jusqu'au début du 20e siècle.
- L'acide benzoïque a été utilisé en thérapie expérimentale des patients atteints de maladies résiduelles d'accumulation d'azote.
Conservation des aliments
- L'acide benzoïque et ses sels sont utilisés dans la conservation des aliments. Le composé est capable d'inhiber la croissance de la moisissure, de la levure et des bactéries, à travers un mécanisme dépendant du pH.
Incommode
Peut réagir avec l'acide ascorbique (vitamine C) présente dans certaines boissons, produisant du benzène, composé cancérigène. Pour cette raison, d'autres composés sont recherchés avec la capacité de conserver des aliments qui ne présentent pas les problèmes de l'acide benzoïque.
Autres
- Il est utilisé dans un emballage actif, étant présent dans les ionomères. D'après eux, l'acide benzoïque est libéré, capable d'inhiber la croissance des espèces de genres Pénicillium et Aspergillus Dans les médias microbiens.
- Il est utilisé comme agent conservateur de l'arôme du jus de fruits et de parfums.
- L'acide benzoïque est utilisé comme herbicide sélectif pour contrôler les mauvaises herbes à larges et les herbes dans les fèves de soja, les concombres, les melons, les arachides et les plantes ornementales ligneuses.
Toxicité
- En contact avec la peau et les yeux, il peut produire des rougeurs. Par inhalation peut provoquer une irritation de la respiration et de la toux. L'apport de grandes quantités d'acide benzoïque peut provoquer des troubles gastro-intestinaux, pouvant atteindre des dommages au foie et rénaux.
- L'acide benzoïque et les benzoates peuvent libérer de l'histamine qui peut provoquer des réactions allergiques et une irritation des yeux, de la peau et des muqueuses.
- Il manque d'effet cumulatif, mutagène ou cancérigène, car il est rapidement absorbé par l'intestin, éliminant dans l'urine sans s'accumuler dans le corps.
- La dose maximale autorisée en fonction de l'OMS est de 5 mg / kg de poids corporel / jour, environ 300 mg / jour. Dose de toxicité aiguë chez l'homme: 500 mg / kg.
Les références
- Acide benzoique. Récupéré de Chemicalbook.com
- Acide benzoique. Récupéré de pubchem.NCBI.NLM.NIH.Gouvernement
- Acide benzoique. Récupéré de.Wikipédia.org

