Fonctions et caractéristiques centriolos
- 1197
- 231
- Prof Noah Collet

Les Centriolos Ce sont des structures cellulaires cylindriques composées de groupes de microtubules. Ils sont formés par la protéine tubuline, qui se trouve dans la plupart des cellules eucaryotes.
Une paire de centrires associée, entourée d'un rapport de masse de matériau dense appelé matériau péricentriolaire (PCM) compose une structure appelée centre.
La fonction des centrioles est de diriger l'assemblage des microtubules, de participation à l'organisation cellulaire (position du noyau et de la disposition spatiale de la cellule), de la formation et de la fonction des flagelles et des cils (cylogenèse) et de la division cellulaire (mitose et méiose).
Les centriolos se trouvent dans les structures cellulaires appelées cellules animales et sont absentes dans les cellules végétales.
Les défauts de la structure ou du nombre de centrioles dans chaque cellule peuvent avoir des conséquences considérables pour la physiologie d'un organisme, produisant des altérations de la réponse au stress pendant l'inflammation, l'infertilité masculine, les maladies neurodégénératives et la formation de tumeurs, entre autres.
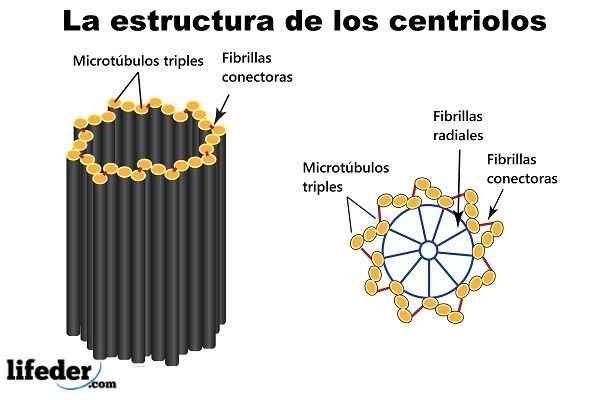
Un centriole est une structure cylindrique. Une paire de centrioles associées, entourée d'un rapport de masse de matériau dense (appelé "matériau péricentriolaire", ou PCM), forme une structure composée appelée "centres".
Ils se considéraient sans importance jusqu'à il y a quelques années, lorsque les principaux organites ont été conclus dans la conduite de la division cellulaire et de la duplication (mitose) dans les cellules eucaryotes (principalement chez l'homme et d'autres animaux).
Le centriol
Neuf triplés de microtubules disposés autour d'une circonférence (formant un cylindre creux court), sont les "blocs de construction" et la structure principale d'un centriolé.
Pendant de nombreuses années, la structure et la fonction des centrioles ont été ignorées, bien que pour les années 1880, les centres aient été visualisés par microscopie optique.
Theodor Boveri a publié un travail fondateur en 1888, décrivant l'origine des centres du sperme après la fertilisation. Dans sa courte communication de 1887, Boveri a écrit que:
«Le centrage représente le centre dynamique de la cellule; Sa division crée les centres des cellules filles formées, autour de laquelle toutes les autres composantes cellulaires sont organisées symétriquement ... Les centres sont le véritable organe de diviseur de la cellule, la moitié de la division nucléaire et cellulaire »(Scheer, 2014: 1). [Traduction de l'auteur].
Peu de temps après le milieu du siècle, avec le développement de la microscopie électronique, le comportement des centrioles a été étudié et expliqué par Paul Schafer.
Malheureusement, ce travail a été ignoré en grande partie au fait que l'intérêt des chercheurs a commencé à se concentrer sur les résultats de Watson et Krick sur l'ADN.
Le centre

Une paire de centrioles, situées à côté du noyau et perpendiculaires les unes aux autres, est "un centrage". L'un des centrioles est connu comme le "père" (ou mère). L'autre est connu comme le "fils" (ou sa fille; il est légèrement plus court et a sa base attachée à la base de la mère).
Les extrémités proximales (à la connexion des deux centrioles) sont immergées dans un «nuage» de protéines (peut-être jusqu'à 300 ou plus) connu sous le nom de Microtubules Organisation Center (MTOC), car il fournit la protéine nécessaire pour la construction de la microtubules.
Peut vous servir: viabilité de la rechercheLe MTOC est également connu sous le nom de «matériau péricentriolaire» et a une charge négative. Inversement, les extrémités distales (loin de la connexion des deux centrioles) sont chargées positivement.
La paire de centrioles, ainsi que le MTOC environnant, sont connues comme le "centre".
Duplication des centres
Lorsque les centrioles commencent à dupliquer, le père et le fils se séparent légèrement, puis chaque centriole commence à former un nouveau centriolo dans sa base: le père avec un nouveau fils, et le fils avec un nouveau fils à lui (un "petit-fils" ).
Alors que la duplication du centriole se produit, l'ADN central est également duplication et séparée. C'est-à-dire que les recherches actuelles démontrent que la duplication du centriole et la séparation de l'ADN sont, en quelque sorte, liées.
Duplication et division cellulaire (mitose)

Le processus mitotique est fréquemment décrit en termes de phase d'initiative, appelée "interface", suivie de quatre phases de développement.
Pendant l'interface, les centrioles doublent et se séparent en deux paires (l'un de ces pairs commence à se déplacer vers le côté opposé du noyau) et l'ADN est divisé.
Après la duplication des centrioles, les microtubules des centrioles s'étendent et s'alignent le long du principal axe du noyau, formant le "fuseau mitotique".
Dans la première des quatre phases de développement (phase I ou «Profas»), les chromosomes se condensent et approchent, et la membrane nucléaire commence à affaiblir et à dissoudre. En même temps, le fuseau mitotique se forme avec les paires de centriols maintenant situées aux extrémités de la broche.
Dans la deuxième phase (phase II ou "métaphase"), les chaînes chromosomes sont alignées sur l'axe de la broche mitotique.
Dans la troisième phase (phase III ou "anaphase"), les chaînes chromosomiques sont divisées et se déplacent vers les extrémités opposées du fuseau mitotique, maintenant allongé.
Enfin, dans la quatrième phase (phase IV ou «télophase»), de nouvelles membranes nucléaires autour des chromosomes séparés sont formées, le fuseau mitotique est défait et la séparation des cellules commence à être achevée avec la moitié du cytoplasme qui accompagne chaque nouveau noyau.
À chaque extrémité de la broche mitotique, les paires centrioles exercent une influence importante (apparemment liée aux forces exercées par les champs électromagnétiques générés par les charges négatives et positives de leurs extrémités proximales et distales) dans toute la cellule de la division cellulaire.
Les centres et la réponse immunitaire
L'exposition au stress influence la fonction, la qualité et la durée de la vie d'un organisme. Le stress généré, par exemple par une infection, peut entraîner une inflammation des tissus infectés, activant la réponse immunitaire dans le corps. Cette réponse protège le corps affecté, éliminant l'agent pathogène.
De nombreux aspects de la fonctionnalité du système immunitaire sont bien connus. Cependant, les événements moléculaires, structurels et physiologiques dans lesquels les centres sont impliqués sont toujours une énigme.
Peut vous servir: rapport d'expérienceDes études récentes ont découvert des changements dynamiques inattendus dans la structure, l'emplacement et la fonction des centres dans différentes conditions liées au stress. Par exemple, après l'imitation des conditions d'une infection, une augmentation de la production de PCM et des microtubules dans les cellules d'interface a été trouvée.
Les centres des synapses immunitaires
Les centres ont un rôle très important dans la structure et la fonction des synapses immunitaires (SI). Cette structure est formée par des interactions spécialisées entre une cellule T et une cellule présentant l'antigène (CPA). Cette interaction cellule-cellule commence la migration du centrage vers le SI et son couplage ultérieur à la membrane plasmique.
Le couplage central dans le SI est similaire à celui observé pendant la cylogénèse. Cependant, dans ce cas, il ne commence pas l'assemblage des cils, mais participe à l'organisation du SI et à la sécrétion de vésicules cytotoxiques pour Lisar les cellules cibles, devenant un organe clé dans l'activation des cellules T.
Centre et stress thermique
Les centres sont la cible de "Chaperonas Molecular" (un ensemble de protéines dont la fonction est d'aider l'assemblage de pliage et le transport cellulaire d'autres protéines) qui offrent une protection contre l'exposition aux chocs thermiques et au stress.
Parmi les facteurs de stress qui affectent les centres, les dommages à l'ADN et à la chaleur sont inclus (comme celui subi par les cellules patientes fébriles). Les dommages à l'ADN commencent les voies de réparation de l'ADN, ce qui peut affecter la fonction des centres et la composition des protéines.
Le stress généré par la chaleur provoque une modification de la structure de la centriole, la perturbation des centres et l'inactivation complète de sa capacité à former des microtubules, modifiant la formation de fuseau mitotique et empêchant la myitose.
L'interruption de la fonction des centres pendant la fièvre pourrait être une réaction adaptative pour inactiver les pôles de la broche et empêcher la division anormale de l'ADN pendant la mitose, en particulier compte tenu du dysfonctionnement potentiel de plusieurs protéines après la dénaturation induite par la chaleur après la dénaturation induite par la chaleur après la chaleur induite par la chaleur après la dénaturation induite par la chaleur après la dénaturation de la chaleur induite par la chaleur après la dénaturation de la chaleur.
De plus, il pourrait fournir la cellule pour récupérer son pool de protéines fonctionnelles avant de redémarrer la division cellulaire.
Une autre conséquence de l'inactivation du centrage pendant la fièvre est son incapacité à se déplacer vers l'organisation de l'organiser et de participer à la sécrétion de vésicules cytotoxiques.
Développement anormal des centrioles
Le développement du centriolo est un processus est assez complexe et, bien qu'une série de protéines régulatrices y participent, différents types d'échecs peuvent se produire.
S'il y a un déséquilibre dans la proportion de protéines, l'enfant Centriolo peut être défectueux, sa géométrie peut être déformée, les axes d'une paire peuvent s'écarter de la perpendiculaire, plusieurs enfants peuvent se développer, le fils centriole peut atteindre toute la longueur avant le temps, ou les paires de découplage peuvent être retardées.
Il peut vous servir: environnement naturel et social en satisfaction des besoins humainsLorsqu'il y a une duplication erronée ou erronée de centrioles (avec des défauts géométriques et / ou une duplication multiple), la réplication de l'ADN est modifiée, l'instabilité chromosomique est présentée (CIN).
De même, les centres des centres (par exemple, un centrage élargi ou élargi) mène à la CIN et à la promotion du développement de multiples enfants centrioles.
Ces erreurs de développement génèrent des dommages aux cellules qui peuvent même conduire à une maligne.
Centrioles anormales et cellules malignes
Grâce à l'intervention des protéines régulatrices, lorsque des anomalies sont détectées dans le développement des centrioles et / ou du centrage, les cellules peuvent mettre en œuvre l'auto-correction des anomalies.
Cependant, si l'auto-correction de l'anomalie, des centrioles anormales ou avec plusieurs enfants ("centrioles surnuméraires" peuvent être obtenues) peuvent conduire à la génération de tumeurs ("tumorigenèse") ou à la mort cellulaire.
Les centrioles surnuméraires ont tendance à se réunir, conduisant au regroupement des centres («amplification des centres», caractéristique des cellules cancéreuses), modifiant la polarité cellulaire et le développement normal de la mitose, entraînant l'apparition de tumeurs.
Les cellules avec des centrioles surnuméraires sont caractérisées par un excès de matériau péricentriolaire, une interruption de la structure cylindrique ou une longueur excessive de centrioles et de centrioles non perpendiculaires ou mal placées.
Il a été suggéré que les grappes de centrioles ou de centres dans les cellules cancéreuses pourraient servir de "biomarqueur" dans l'utilisation d'agents thérapeutiques et imaginologiques, tels que des nanoparticules super-paramagnétiques.
Les références
- Borisy, g., Heald, R., Howard, J., Janke, C., Musacchio, un., & Nogales, et. (2016). Microtubules: 50 ans après la découverte de la tubuline. Nature Reviews Molecular Cell Biology, 17 (5), 322-328.
- Buchwalter, R. POUR., Chen, J. V., Zheng, et., & Megraw, t. L. Centres de division cellulaire, de développement et de maladie. els.
- Gambarotto, D., & Basto, R. (2016). Conception des défauts des centres numériques en matière de développement et de maladie. Dans le cystosquelette des microtubules (pp. 117-149). Springer Vienne.
- Huston, R. L. (2016). Une revue de l'activité centriole et de l'activité injustifiée, pendant la division cellulaire. Advances in Bioscience and Biotechnology, 7 (03), 169.
- Inaba, k., & Mizuno, k. (2016). Dysfonctionnement du sperme et ciliopathie. Reproductive Medicine and Biology, 15 (2), 77-94.
- Keeling, J., Tsiokas, l., & Maskey, D. (2016). Mécanismes cellulaires du contrôle de la longueur ciliaire. Cellules, 5 (1), 6.
- Lodish, H., Berk, un., Kaiser, C. POUR., Krieger, m., Bretscher, un., Ploegh, H., Amon, un., Martin, K. C. (2016). Biologie des cellules moléculaires. New York: W. H. Freeman et compagnie.
- Matamoros, un. J., & Baas, p. W. (2016). Microtubules de santé et de maladie dégénérative du système nerveux. Bulletin de recherche sur le cerveau, 126, 217-225.
- Pellegrini, L., Wetzel, un., Grannó, s., Heaton, G., & Harvey, K. (2016). Retour au tubule: dynamique des microtubules dans la maladie de Parkinson. Sciences de la vie cellulaire et moléculaire, 1-26.
- Scheer, u. (2014). Racines historiques de la recherche sur les centres: découverte des diapositives du microscope de Boveri à Würzburg. Phil. Trans. R. Soc. B, 369 (1650), 20130469.

