Formation de carbocation, caractéristiques, types, stabilité
- 2942
- 351
- Noa Da silva
UN carbocation, Comme son nom l'indique, c'est un ion organique qui a un atome de carbone chargé positivement, qui se caractérise par un très instable, existant pendant une courte période. C'est généralement un intermédiaire dans les réactions organiques, c'est-à-dire qu'elle provient comme des étapes indispensables des mécanismes moléculaires respectifs.
Historiquement, il y a eu des points de conflit dans la compression de ce qu'est le carbocation. En effet, il existe des symphines de molécules réactives qui, pour une raison ou une autre, acquiert une charge positive dans l'un de leurs carbones. La carbocation classique, pour ainsi dire, est celle qui peut être représentée par la formule générale de l'image ci-dessous.
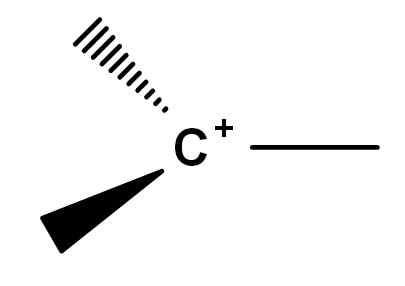 Formule générale d'un carbocation. Source: Gabriel Bolívar.
Formule générale d'un carbocation. Source: Gabriel Bolívar. Notez comment la charge positive est située exactement sur l'atome de carbone et manque également d'un lien. Par conséquent, le carbocation est des électrons pauvres, ce qui est la cause de sa forte réactivité.
Supposons que le méthane, Cho4. Si le carbone perdait l'un de ses atomes d'hydrogène, nous éliminons l'une des quatre liaisons C-H. Puis le carbocation de méthyle est originaire, ch3+, que nous pourrions représenter simplement en plaçant les atomes d'hydrogène aux extrémités des rayures de la formule supérieure. Le ch3+ C'est le plus simple de toutes les carbocations.
[TOC]
Entraînement
Comment se forment les carbocations? La réponse se trouve dans les mécanismes des réactions. Cependant, la grande majorité partage en commun l'un des deux aspects suivants:
-Rupture hétérolytique
-Ajout d'électrons π à un électrophile
Rupture hétérolytique
Dans la rupture hétérolithique de la liaison C-G, G étant tout atome ou groupe, il est cassé de manière inégale: les électrons de la liaison sont laissés g, tandis que l'atome de carbone acquiert une charge positive. Par exemple:
Peut vous servir: Arsenic: histoire, structure, propriétés, utilisations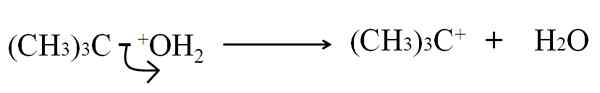 Rupture hétérolytique dans la déshydratation du tertanol. Source: Gabriel Bolívar.
Rupture hétérolytique dans la déshydratation du tertanol. Source: Gabriel Bolívar. Maintenant, cette rupture peut être donnée pour plusieurs méthodes, ce qui à son tour changera le mécanisme et la réaction considérés.
Ajout d'électrons π à un électrophile
L'autre processus par lequel une carbocation est formée, étant très courante dans les alcènes et composés aromatiques, est en attaquant les électrons d'une double liaison à un électrophile. Les cas les plus courants sont l'hydrogénation des alcènes par l'action d'un acide:
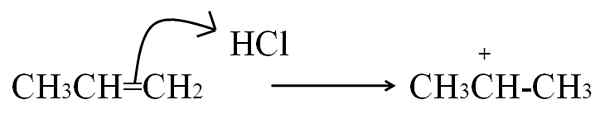 Réaction HCl avec le Propeno pour former un carbocation en tant qu'intermédiaire. Source: Gabriel Bolívar.
Réaction HCl avec le Propeno pour former un carbocation en tant qu'intermédiaire. Source: Gabriel Bolívar. Cette équation correspond à la formation de carbocation, qui c'est un intermédiaire, Pas un produit. Les électrons à double liaison attaquent l'hydrogène HCl, l'électrophile. L'hydrogène est ajouté au carbone à droite de la double liaison, donc le groupe -ch est formé3, Tandis que le carbone de gauche acquiert la charge positive.
Caractéristiques
Hybridation
La formule générale présentée au début révèle une géométrie plate trigonale autour de l'atome de carbone. Cela est dû à l'hybridation subie par les orbitales atomiques carbone pour devenir des orbitales SP hybrides2, qui sont séparés à un angle de 120º. Bien qu'il ne soit pas représenté, le carbocation a une orbitale p Pur et vide, capable d'accepter les électrons.
Acidité
La carbocation est une espèce acide, soit selon la définition de Brönsted, soit Lewis. Leurs électrons de demande de charge positive ou les atomes d'hydrogène qui sont donnés. C'est pour cette raison que les carbocations ne peuvent pas être formées dans des médias très basiques, car ils réagiraient immédiatement à d'autres produits.
La stabilité
L'hybridation sp2 de carbocation le rend vulnérable aux attaques d'espèces riches en électrons. Cette fonctionnalité est encore accentuée par sa grande acidité. Par conséquent, la carbocation est une espèce très réactive, qui est à peine formée et bientôt (en une question de nanosecondes) réagir pour donner naissance au véritable produit de la réaction chimique.
Peut vous servir: acide sulfamique: structure, propriétés, synthèse, utilisationsTypes de carbocations
Il existe plusieurs types de carbocations. Cependant, ceux-ci peuvent être classés comme suit:
-Primaire
-Secondaire
-Tertiaire
-Aromatique ou arillos
-Vinyle et alilique
Primaire
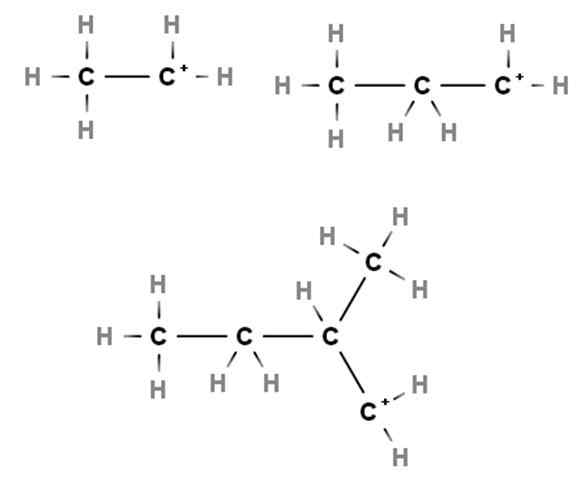 Carbocations primaires. Source: Gabriel Bolívar via Molview.
Carbocations primaires. Source: Gabriel Bolívar via Molview. Les arrivées montrent des exemples de carbocations primaires. Ils sont appelés ainsi parce que la charge positive réside dans un carbone primaire, 1er, il n'est donc lié qu'à un atome de carbone. Etano, ch3Ch3, Lorsqu'un h perd l'une de ses extrémités, Carbocation Cho3Ch2+ soit +Ch2Ch3.
Secondaire
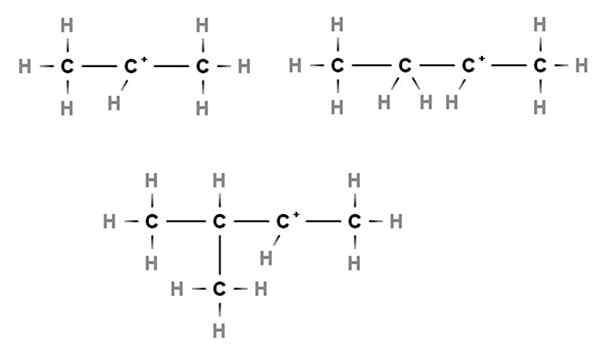 Carbocations secondaires. Source: Gabriel Bolívar via Molview.
Carbocations secondaires. Source: Gabriel Bolívar via Molview. Dans les carbocations secondaires, la charge positive est située dans un carbone secondaire, 2e, qui est lié à deux atomes de carbone. Par exemple, si le propane, Cho3Ch2Ch3, Nous enlevons un H du carbone central, nous aurons le carbocation Cho3Ch2+Ch3.
Tertiaire
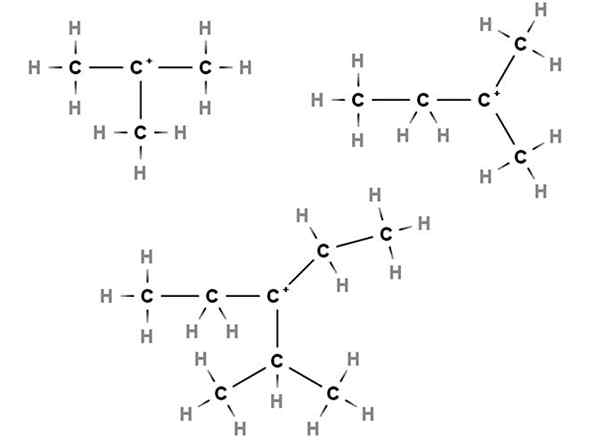 Carbocations tertiaires. Source: Gabriel Bolívar via Molview.
Carbocations tertiaires. Source: Gabriel Bolívar via Molview. Dans les carbocations tertiaires, la charge positive est située dans un carbone tertiaire, 3e, lié à trois atomes de carbone. Notez que contrairement aux deux premiers types de carbocations, ils manquent d'atomes d'hydrogène.
Ainsi, nous avons du méthylpropane ou de l'isobutane, CH (CH (Choisissez3)3, Qui en perdant un hydrogène, le carbone central forme du carbocation +C (ch3)3.
Aromatique
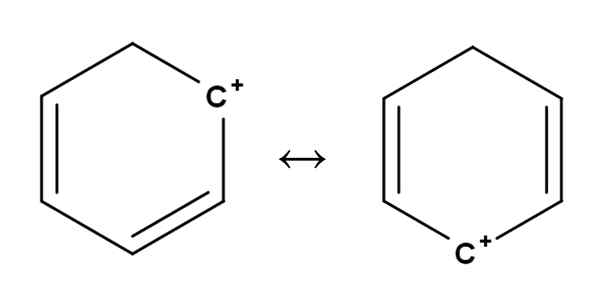 Benzène carbocat. Source: Gabriel Bolívar.
Benzène carbocat. Source: Gabriel Bolívar. Les carbocations aromatiques ou aromatiques sont peut-être les plus spéciales. Votre formation est très similaire à celle décrite pour les alcènes dans la première section.
En eux, la charge positive est située, en principe, dans l'un des carbones d'un anneau aromatique, comme le benzène. Cependant, la charge positive n'est pas fixe, mais est dispersée dans d'autres positions d'anneau par résonance.
Il peut vous servir: Ribulosa-1,5-Biphosphate (RUBP): Caractéristiques, carbolixationC'est ainsi que la charge positive, comme on le voit ci-dessus, passe d'un carbone à un autre à l'intérieur de la bague benzène. Cette caractéristique donne à cette carbocation une grande stabilité contre les autres types de carbocations.
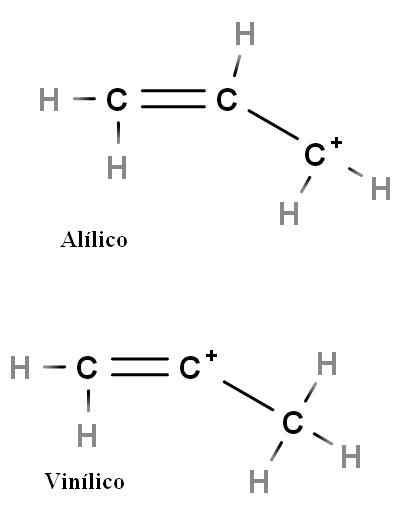
Allylique et vinyle
 Carbocation allylique et vinyle. Source: Gabriel Bolívar.
Carbocation allylique et vinyle. Source: Gabriel Bolívar. D'autres types spéciaux de carbocations sont les aliliques et le vinyle. La différence entre eux (ci-dessus) est la position de la charge positive liée à la double liaison.
Dans le carbocation en vinyle, la charge positive se trouve dans l'un des carbones à double liaison; Pendant que dans le carbocation allyique, la charge positive est située dans le carbone après la double liaison. Il suffit de remplacer les hydrogènes par d'autres groupes et nous aurons une énorme famille de carbocations allyiques et vinyles.
Stabilité relative
Sachant quels sont les principaux types de carbocations, ils peuvent être commandés en fonction de leur stabilité relative:
Vinyle < Primario < Secundario < Alílico < Terciario < Aromático
Maintenant, il peut y avoir des carbocations alliques plus stables qu'un tertiaire spécifique. Tout dépendra de leurs substituants.
Pourquoi cette stabilité? À la capacité de la molécule à se disperser ou à réduire la charge positive de carbocation. Pour ce faire, vous avez besoin d'atomes proches qui donnent une partie de sa densité de carbocation électronique par hyperconjugaison. Entre-temps, dans les carbocations en alumique et aromatique, celle-ci est réalisée par résonance.
Dans le cas de la carbocation en vinyle, la charge positive est située sur un carbone déjà SP2, ce qui le rend très instable.
Les références
- Graham Salomons t.W., Craig B. Fryhle. (2011). Chimie organique. (dixe Édition.). Wiley Plus.
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Morrison et Boyd. (1987). Chimie organique. (Cinquième édition). Addison-wesley iberoamericana.
- Wikipédia. (2020). Carbocation. Récupéré de: dans.Wikipédia.org
- James Ashenhurst. (20 février 2020). 3 facteurs qui stabilisent les carbocations. Récupéré de: MasterOganicchemistry.com
- Clark Jim. (2000). Carbocations (ou ions carbonium). Récupéré de: Chemguide.co.ROYAUME-UNI
- Docteur. Kennepohl, professeur. S. Agriculteur & t. Soderberg. (10 août 2020). Structure et stabilité de la carbocation. CHIMISTER BOOLISTexts. Récupéré de: Chem.Bibliothèque.org
- « Concept de codes éthiques environnementaux, caractéristiques et exemples
- Les 4 stations de l'année au Mexique et ses caractéristiques »

