Structure du bromure de lithium, propriétés, utilisations, risques
- 1694
- 458
- Paul Dumas
Il Bromure de lithium C'est un sel neutre d'un métal alcalin dont la formule chimique est le bibliothèque. La formule exprime que son solide cristallin est composé de li ions+ et br- Dans un rapport 1: 1. Vos cristaux sont blancs ou beige léger. Il est très soluble dans l'eau et aussi, c'est un sel plutôt hygroscopique.
Cette dernière propriété permet son utilisation comme dessiccant dans les systèmes de climatisation et de refroidissement. De même, le bromure de lithium a été utilisé depuis le début du 20e siècle dans le traitement de certains troubles de la santé mentale, abandonnant son utilisation en raison de l'utilisation inappropriée de sel.
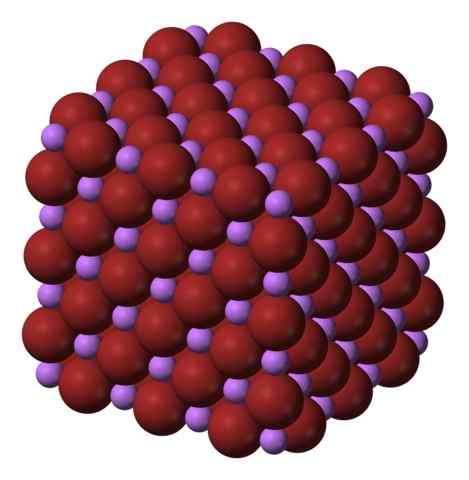
 Structure cristalline cubique du lib. Source: Benjah-Bmm27 via Wikipedia.
Structure cristalline cubique du lib. Source: Benjah-Bmm27 via Wikipedia. Le liber est produit par le traitement du carbonate de lithium, Li2CO3, avec de l'acide bromhytérique. Après le réchauffement du milieu, précipite dans la solution aqueuse sous forme d'hydrate.
Ce sel irrite la peau et les yeux par contact, tout en produisant l'irritation des canaux respiratoires par inhalation. L'apport de sels de lithium peut provoquer des nausées, des vomissements, une diarrhée et des étourdissements.
[TOC]
Structure de bromure de lithium
La formule du libel indique clairement que la proportion LI / BR est égale à 1; Pour chaque cation li+ Il doit y avoir un Br Anion- de homologue. Par conséquent, cette proportion doit être maintenue constante dans tous les coins du cristal de bibliothèque.
Les ions li+ et br- Ils s'attirent mutuellement, réduisant les répulsions entre les charges égales, afin de provoquer un type de gemme à cristal cube; Ceci est isomorphe à NaCl (image supérieure). Notez que l'ensemble entier a une géométrie cubique.
Dans ce cristal, le li+ Ils sont plus petits et ont une couleur violette légère; Pendant que le BR- Ils sont plus volumineux et une couleur brune intense. On observe que chaque ion compte six voisins, ce qui est la même chose que de dire qu'ils présentent une coordination octaédrique: Libr6 ou li6BR; Cependant, si la cellule unitaire est considérée, la proportion li / br reste 1.
Peut vous servir: structure cristallineCeci est la structure cristalline adoptée de préférence par le lib. Cependant, il peut également former d'autres types de cristaux: Wurzita, s'il cristallise à basse température (-50 ° C) sur un substrat; O Coube centré sur le corps, ou type CSCL, si le sel en verre cube est soumis sous haute pression.
Hydrate et verre
Ce qui précède est applicable à la bibliothèque anhydre. Ce sel est hygroscopique et peut donc absorber l'humidité de l'environnement, entrecourant les molécules d'eau dans leurs propres cristaux. Ainsi, les hydrates de libr · NH surgissent2Ou (n = 1, 2, 3 ..., 10). Pour chaque hydrate, la structure cristalline est différente.
Par exemple, des études cristallographiques ont déterminé que le libr · h2Ou adoptez une structure de type Perovskita.
Lorsque ces hydrates sont en solution aqueuse, elles peuvent se débarquer et se vitrifier; C'est-à-dire qu'ils adoptent une structure cristalline, mais moléculairement désordonnée. Dans de telles conditions, les ponts d'hydrogène de l'eau deviennent assez importants.
Propriétés
Poids moléculaire
88 845 g / mol.
Apparence
Solide cristallin blanc ou beige clair.
Odeur
Toilettes.
Point de fusion
552 ºC (1.026 ºF, 825 K).
Point d'ébullition
1.256 ºC (2.309 ºF, 1.538 k).
Solubilité dans l'eau
166,7 g / 100 ml à 20 ° C. Notez votre solubilité élevée.
Solubilité dans les solvants organiques
Soluble dans le méthanol, l'éthanol, l'éther et l'acétone. Légèrement soluble dans la pyridine, composé aromatique et moins polaire que les précédents.
Indice de réfraction (ηd)
1 784.
Capacité calorique
51,88 J / mol · k.
Entropie molaire standard (Sθ 298)
66,9 J / mol · k.
point d'allumage
1.265 ºC. Est considéré comme non flammable.
La stabilité
Écurie. La forme anhydrate, cependant, est extrêmement hygroscopique.
Décomposition
Lorsqu'il se décompose par le réchauffement, il provoque l'oxyde de lithium.
Peut vous servir: acide chlorogéniquepH
Entre pH 6 et 7 en solution aqueuse (100 g / L, 20 ºC).
Réactivité
Le bromure de lithium n'est pas réactif dans des conditions environnementales normales. Cependant, vous pouvez subir des réactions intenses avec des acides forts lorsque la température augmente.
Lors de la dissolution dans l'eau, il y a une augmentation de la température, causée par une enthalpie négative d'hydratation.
Production
La bibliothèque se produit en réagissant à l'hydroxyde de lithium ou au carbonate de lithium avec de l'acide bromhytérique dans une réaction de neutralisation:
Li2CO3 + HBR => Libr + Co2 + H2SOIT
Le bromure de lithium est obtenu sous forme d'hydrate. Pour obtenir une forme anhydre, il est nécessaire de chauffer le sel hydraté sous vide.
Nomenclature
Le nom «Bromide au lithium» dérive d'un halogogénide métallique, nommé selon la nomenclature des stocks. Les autres noms, également valides mais moins utilisés, sont la monobromure du lithium, selon la nomenclature systématique; et le bromure lithique (la valence unique de +1 pour le lithium), selon la nomenclature traditionnelle.
Applications
Dessicant
Le Liber est un sel hygroscopique, formant une saumure concentrée capable d'absorber l'humidité de l'air dans une large gamme de températures. Cette saumure est utilisée comme dessiccant dans les systèmes de climatisation et de refroidissement.
Fibres
Il est utilisé pour augmenter le volume de laine, de cheveux et d'autres fibres biologiques.
Adduits pharmaceutiques
Le liber forme des adduits avec certains composés pharmaceutiques, modulant son action. Un adduit est la combinaison en coordonnant deux ou plusieurs molécules, sans altération structurelle d'aucune des molécules unies.
Sédatif
Le bromure de lithium a été utilisé au début comme sédatif dans certains troubles mentaux, cessez d'utiliser en 1940. Actuellement, le carbonate de lithium est utilisé; Mais en tout cas, le lithium est l'élément qui exerce l'action thérapeutique dans les deux composés.
Il peut vous servir: oxyde de plombose (PBO): formule, propriétés, risques et utilisationsLe lithium est utilisé dans le traitement du trouble bipolaire, ayant été utile dans le contrôle des épisodes maniaques du trouble. On pense que le lithium inhibe l'activité des neurotransmetteurs excitateurs, tels que la dopamine et l'acide glutamique.
D'un autre côté, l'activité du système inhibiteur médié par le neurotransmetteur gamma-aminé-acide-butyrique (GABA) augmente (GABA). Ces actions pourraient faire partie de la base de l'action thérapeutique du lithium.
Des risques
Contacter la toxicité
Irritation et sensibilisation cutanées, allergies. Des blessures aux yeux graves ou une irritation des yeux, sur les voies respiratoires, les narines et la gorge.
Ingestion
Les principaux symptômes dus à l'apport de bromure de lithium sont: les troubles gastro-intestinaux, les vomissements et les nausées. Les autres effets néfastes sur l'ingestion de sel comprennent l'agitation, les spasmes et la perte de conscience.
La condition connue sous le nom de «brommisme» peut se produire avec une dose de bromure de lithium supérieure à 225 mg / jour.
Dans le brommisme, certains des symptômes et signes suivants peuvent survenir: exacerbation de l'acné et perte d'appétit, tremblements, problèmes de parole, apathie, faiblesse et agitation maniaque.
Les références
- Formulation chimique. (2019). Bromure de lithium. Récupéré de: Formulation Quimica.com
- David C. Johnson. (10 juillet 2008). Nouveau ordre de bromure de lithium. Nature. est ce que je.org / 10.1038 / 454174A
- Aayushi jain & r.C. Dixit. (s.F.). Transition de phase structurelle dans le bromure de lithium: effet de pression et de température. [PDF]. Récupéré de: NCPCM.dans
- Takamuku et al. (1997). Études de diffraction des rayons X sur les solutions de bromure de lithium aqueux surflue et de lithium. Département de chimie, Faculté des sciences, Université Fukuoka, Nanakuma, Jonan-Ku, Fukuoka 814-80, Japon.
- Centre national d'information sur la biotechnologie. (2019). Bromure de lithium. Base de données PubChem, CID = 82050. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement
- Wikipédia. (2019). Bromure de lithium. Récupéré de: dans.Wikipédia.org
- Société royale de chimie. (2019). Bromure de lithium. Chemspider. Récupéré de: Chemspider.com
- « Propriétés d'alkyl halogogenuros, obtention, exemples
- Le Mexique dans les actes et changements socioéconomiques du XVIIIe siècle »

