Structure, fonction, mécanisme, importance de la pompe à sodium de potassium, importance
- 2863
- 120
- Anaïs Julien
La Bombe de sodium de potassium Il s'agit d'une structure protéique incluse dans un ensemble plus large de molécules présentes dans de nombreuses membranes cellulaires, et qui sont responsables du transport actif d'ions ou d'autres petites molécules contre ses gradients de concentration. Ils utilisent l'énergie libérée par l'hydrolyse ATP et c'est pourquoi ils sont génériquement appelés atasas.
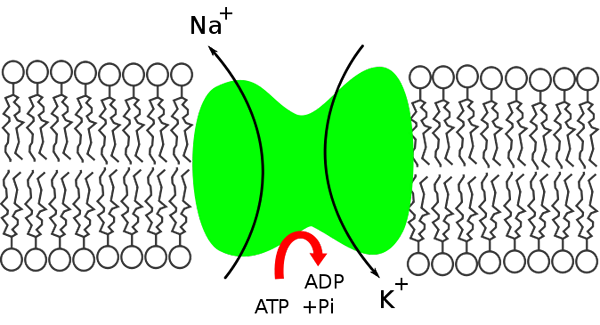
La pompe de sodium en potassium est un Na + / K + ATPay car il libère l'énergie contenue dans la molécule ATP pour déplacer le sodium à l'intérieur de la cellule, en introduisant, en même temps, du potassium.
 Schéma de bombes sodium de potassium. Extérieur et intérieur de la cellule. (Source: Miguefegerig, via Wikimedia Commons)
Schéma de bombes sodium de potassium. Extérieur et intérieur de la cellule. (Source: Miguefegerig, via Wikimedia Commons) À l'intérieur de la cellule, le sodium est moins concentré (12 meq / L) qu'à l'extérieur (142 mEq / L), tandis que le potassium est plus concentré à l'extérieur (4 mEq / L) que l'intérieur (140 meq / L).
Les bombes atasas sont classées en trois grands groupes:
- Pompes ioniques de type F et V: Ce sont des structures assez complexes, elles peuvent être constituées de 3 types différents de sous-unités transmarket et jusqu'à 5 polypeptides associés dans le cytosol. Ils fonctionnent comme des transporteurs de protons.
- Superfamille ABC (d'anglais POURTp-BIndageant CActif = Cassette Union ATP): intégrée par plus de 100 protéines qui peuvent fonctionner comme des convoyeurs ioniques, des monosaccharides, des polysaccharides, des polypeptides et même d'autres protéines.
- Pompes ioniques de la classe P: Formé par au moins une sous-unité catalytique alpha transmembraal qui a un site syndical pour l'ATP et une sous-unité β mineure. Pendant le processus de transport, la sous-unité α est la phosphoryila et donc son nom «P».
La bombe de potassium sodium (Na + / K + ATPASA) appartient au groupe de pompes ioniques de classe P et a été découverte en 1957 par Jens Skou, un chercheur danois, lorsqu'il a étudié le mécanisme d'action des anesthésiques dans les nerfs d'un crabe (CARCINUS MÉNAS)); Travail pour lequel le prix Nobel de chimie a été décerné en 1997.
 Bombe de sodium de potassium. Nakpompe2.Jpg: phi-gastrein à froid.Wikipediaderivative Work: Sonia / cc by-s (http: // CreativeCommons.Org / licences / by-sa / 3.0 /)
Bombe de sodium de potassium. Nakpompe2.Jpg: phi-gastrein à froid.Wikipediaderivative Work: Sonia / cc by-s (http: // CreativeCommons.Org / licences / by-sa / 3.0 /) [TOC]
Structure de la pompe à sodium de potassium
La pompe à sodium de potassium est une enzyme qui, du point de vue de sa structure quaternaire, est formée par 2 sous-unités protéiques Alfa (α) et deux types bêta (β).
Il s'agit donc d'un tétramère de type α2β2, dont les sous-unités sont des protéines membranaires complètes, c'est-à-dire qu'elles traversent la bicouche lipidique et ont à la fois des domaines intra et cytosoliques supplémentaires.
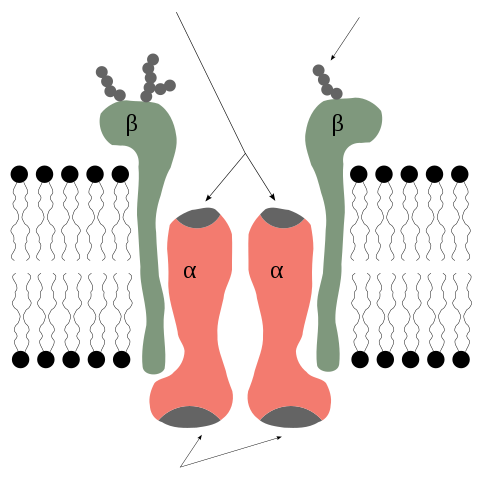 Sous-unités alpha et bêta de la pompe à potassium. Rob Cowie / CC BY-SA (http: // CreativeCommons.Org / licences / by-sa / 3.0 /)
Sous-unités alpha et bêta de la pompe à potassium. Rob Cowie / CC BY-SA (http: // CreativeCommons.Org / licences / by-sa / 3.0 /) Subsités alpha
Les sous-unités α sont celles qui contiennent les sites syndicaux pour l'ATP et pour les ions Na + et K + et représentent la composante catalytique de l'enzyme et celle qui exerce la fonction de la bombe elle-même elle-même.
Les sous-unités α sont des polypeptides de grande taille, avec un poids moléculaire de 120 kDa, 10 segments transmembranaux et avec leurs extrémités N et C-terminales situées du côté cytosolique.
Ils ont sur les sites d'union latérale intracellulaire pour l'ATP et pour le NA +, ainsi qu'un résidu aspartate en position 376 qui représente le site subi par le processus de phosphorylation pendant l'activation de la pompe.
Le site de liaison du K + est apparemment du côté extracellulaire.
Sous-unités bêta
Les sous-unités β ne semblent pas avoir une participation directe à la fonction de pompage, mais en leur absence, cette fonction ne se produit pas.
Les sous-unités β ont un poids moléculaire d'environ 55 kDa chacun et sont des glycoprotéines avec un seul domaine transmarket dont les déchets glucides sont insérés dans la région extracellulaire.
Peut vous servir: feuille basale: caractéristiques, histologie et fonctionsIls semblent être nécessaires dans le réticulum endoplasmique, où ils contribueraient au pliage approprié des sous-unités α, puis, au niveau de la membrane, pour stabiliser le complexe.
Les deux types de sous-unités sont hétérogènes et ont été décrits jusqu'à présent jusqu'à présent les isoformes α1, α2 et α3 pour l'UNA, et β1, β2 et β3 pour l'autre. Le α1 se trouve dans les membranes de la plupart des cellules, tandis que α2 est présent dans le muscle, le cœur, le tissu adipeux et le cerveau et α3 dans le cœur et le cerveau.
L'isoforme β1 est la distribution la plus diffuse, bien qu'elle soit absente dans certains tissus tels que les cellules vestibulaires de l'oreille interne et la réponse rapide des cellules musculaires glycolytiques. Ces derniers ne contiennent que β2.
Les différentes structures des sous-unités qui composent la pompe Na + / K + dans les différents tissus peuvent obéir aux spécialisations d'un type fonctionnel mais élucidé.
Fonction de pompe à potassium
Pour tout temps considéré, la membrane plasmique constitue une limite de séparation entre le compartiment correspondant à l'intérieur d'une cellule et celle qui représente le liquide extracellulaire dans lequel il est immergé.
Les deux compartiments ont une composition qui peut être qualitativement différente, car à l'intérieur des cellules, il y a des substances qui ne sont pas hors d'eux et le liquide extracellulaire contient des substances qui ne sont pas présentes de manière intracellulaire.
Les substances présentes dans les deux compartiments peuvent être trouvées à différentes concentrations, et ces différences peuvent posséder une signification physiologique. C'est le cas de nombreux ions.
Entretien de l'homéostasie
La pompe Na + / K + remplit une fonction fondamentale dans le maintien de l'homéostasie intracellulaire en contrôlant les concentrations de sodium et d'ions potassiques. Ce maintien de l'homéostasie y parvient grâce à:
- Transport d'ions: introduit des ions sodium et expulse les ions de potassium, le processus par lequel il favorise également le mouvement d'autres molécules à travers d'autres transporteurs qui dépendent de la charge électrique ou de la concentration interne de ces ions.
- Contrôle du volume de cellules: L'introduction ou la sortie des ions implique également des mouvements d'eau dentre de la cellule, de sorte que la pompe participe au contrôle du volume de cellules.
- Génération potentielle de la membrane: L'expulsion de 3 ions sodium pour chaque 2 ions de potassium introduits provoque la membrane. Cette différence est connue sous le nom de potentiel de repos.
Le Na + a une concentration extracellulaire d'environ 142 mEq / L, tandis que sa concentration intracellulaire n'est que de 12 MEQ / L; Le K +, en revanche, est plus concentré dans la cellule (140 meq / L) que l'extérieur (4 meq / L).
Bien que la charge électrique de ces ions ne permette pas leur passage à travers la membrane, il existe des canaux ioniques qui le permettent (sélectivement), qui favorisent le mouvement si les forces qui déplacent normalement ces ions sont également présents.
Peut vous servir: récepteurs membranaires: fonctions, types, comment ils fonctionnentMaintenant, ces différences de concentration ont une grande importance dans le conservation de l'homéostasie de l'organisme et doit être maintenu dans une sorte d'équilibre qui serait perdu.
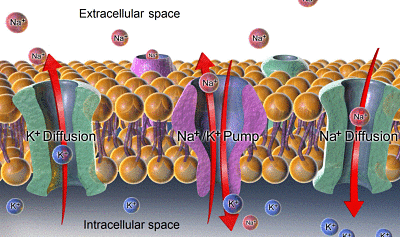 Dissémination et sodium de potassium (Source: Bruceblaus. Lorsque vous utilisez cette image dans des sources externes, il peut être cité comme: Blausen.COM PERSONNEL (2014). "Galerie médicale de Blausen Medical 2014". Wikijournal de médecine 1 (2). Doi: 10.15347 / WJM / 2014.010. ISSN 2002-4436.Dérivé par Mikael Häggström / cc par (https: // CreativeCommons.Org / licences / par / 3.0) via Wikimedia Commons)
Dissémination et sodium de potassium (Source: Bruceblaus. Lorsque vous utilisez cette image dans des sources externes, il peut être cité comme: Blausen.COM PERSONNEL (2014). "Galerie médicale de Blausen Medical 2014". Wikijournal de médecine 1 (2). Doi: 10.15347 / WJM / 2014.010. ISSN 2002-4436.Dérivé par Mikael Häggström / cc par (https: // CreativeCommons.Org / licences / par / 3.0) via Wikimedia Commons) - La différence de concentration pour le Na + entre l'intérieur et en dehors de la cellule crée un gradient chimique qui pousse le sodium vers l'intérieur et rend cet ion qui entre constamment et rythme pour dissiper cette différence, c'est-à-dire pour correspondre aux concentrations des deux côtés.
- Le gradient de potassium est maintenu dans la direction opposée, c'est-à-dire à l'intérieur, permettant la sortie constante de l'ion et sa réduction interne et une augmentation externe.
La fonction de la pompe Na + / K + permet l'extraction du sodium qui est entré par diffusion à travers des canaux ou par d'autres voies de transport et la réintroduction du potassium qui a été diffusé vers l'extérieur, permettant la conservation des concentrations intra et extracellulaires de ces ions.
Mécanisme (processus)
Le mécanisme d'action de l'ATPase Na + / K + se compose d'un cycle catalytique qui implique des réactions de transfert d'un groupe phosphoryle (PI) et des changements conformationnels de l'enzyme qui passe d'un état E1 à un état E2 et vice versa.
L'opération nécessite la présence d'ATP et de Na + à l'intérieur de la cellule et K + dans le liquide extracellulaire.
Union d'ions sodium au transporteur
Le cycle commence dans l'état de conformation E1 de l'enzyme, dans lequel il existe 3 sites cytosoliques d'union Na + et une affinité élevée (km de 0,6 mm) qui sont entièrement occupées parce que la concentration intra.
Hydrolyse ATP
Dans cet état (E1) et avec le Na + fixé à ses sites syndicaux, l'ATP est fixé à son site dans le secteur cytosolique de la molécule, un groupe de phosphate à l'aspartate 376 est transféré et transféré, formant un acilphosphate à haute énergie qui induit Un changement conformationnel à l'état E2.
Expulsion de 3 ions sodium et introduction de 2 ions de potassium
Le changement de conformation de l'État E2 implique que les sites de l'Union NA + passent à l'étranger, leur affinité pour l'ion diminue beaucoup et est libérée dans le liquide extracellulaire, tandis que, en même temps, l'affinité des sites de l'Union au K + augmente Et ces ions se lient à la pompe.
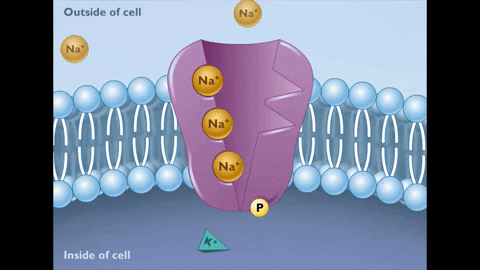 Pendant l'état E2, les ions de Na + sont libérés de l'autre côté de la membrane.
Pendant l'état E2, les ions de Na + sont libérés de l'autre côté de la membrane. 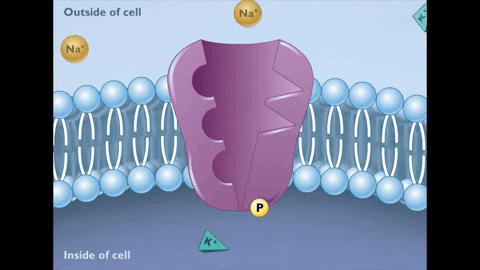 À son tour, ce nouvel état de la pompe génère une affinité pour l'union des ions+
À son tour, ce nouvel état de la pompe génère une affinité pour l'union des ions+ Inversion de E2 à E1
Une fois le Na + libéré et le K + unis, l'hydrolyse du phosphate d'aspartyle est produite et le changement de conformation de l'état E2 à l'état E1 est inversé, avec la réintroduction des sites de l'Union pour le Na + vide et ceux de K + occupés.
Lorsque ce changement se produit, les sites de Na + récupèrent leur affinité et ceux de K + le perdent, avec lequel le K + est libéré à l'intérieur de la cellule.
Importance
Dans le maintien de l'osmolarité cellulaire
La bombe Na + / K + a été présente dans la plupart, sinon en tout, les cellules de mammifères, dans lesquelles il est d'une importance générale en contribuant à maintenir son osmolarité et donc son volume.
Peut vous servir: peroxydases: structure, fonctions et typesL'entrée continue des ions sodium dans la cellule conditionne une augmentation du nombre intracellulaire de particules osmotiquement actives, ce qui induit l'entrée de l'eau et l'augmentation du volume qui finirait par provoquer la rupture de la membrane et de l'effondrement de la cellule.
Dans la formation du potentiel membranaire
Comme ces pompes n'introduisent que 2 K + pour tous les 3 Na + qu'elles retirent, elles se comportent électrogéniquement, ce qui signifie qu'ils "décompensent" des charges électriques internes, favorisant la production du potentiel membranaire caractéristique des cellules du corps.
Son importance est également évidente par rapport aux cellules qui composent les tissus excitables, dans lesquels les potentiels d'action sont caractérisés par l'entrée de l'ion Na +, qui dépolarise la cellule, et la sortie de K +, qui la reprolarise.
Ces mouvements ioniques sont possibles grâce au fonctionnement des pompes Na + / K +, qui contribuent à la production de gradients chimiques qui déplacent les ions impliqués.
Sans ces pompes, qui fonctionnent dans la direction opposée, les gradients de concentration de ces ions se dissiperaient et l'activité excitatrice disparaîtrait.
En fonction rénale
Un autre aspect qui met en évidence l'extrême importance des bombes sodium-potassium est en relation avec la fonction rénale, qui ne serait pas impossible.
La fonction rénale implique la filtration quotidienne de plus ou moins 180 litres de plasma et de grandes quantités de substances, dont certaines doivent être excrétées, mais beaucoup doivent être réabsorbées afin qu'elles ne soient pas perdues dans l'urine.
La résorption du sodium, de l'eau et de nombreuses substances filtrées dépend de ces pompes, qui sont situées dans la membrane basolatérale des cellules qui composent les épithéliums des différents segments tubulaires des néphrons rénaux.
Les cellules épithéliales qui montent en monnaie les tubules rénales ont un visage qui est en contact avec la lumière du tubule et qui est appelé la face apicale, et une autre qui est en contact avec l'interstitium autour du tubule et appelé basolaterale.
L'eau et les substances réabsorbées doivent d'abord passer à l'intérieur de la cellule à travers l'apical puis à l'interstitium par le basolatéral.
La réabsorption de Na + est la clé à la fois par rapport à lui, et par rapport à celle de l'eau et de celle d'autres substances qui dépendent de son. L'entrée apicale de Na + la cellule nécessite qu'il y ait un gradient qui le déplace et qui implique une très faible concentration de l'ion à l'intérieur de la cellule.
Cette faible concentration intracellulaire de Na + est produite par des pompes de sodium de la membrane basolatérale qui fonctionnent intensément pour éliminer l'ion des cellules à l'interstitium.
Les références
- Ganong WF: La base générale et cellulaire de la physiologie médicale, dans: Revue de la physiologie médicale, 25e ed. New York, McGraw-Hill Education, 2016.
- Guyton AC, Hall Ji: Transport de substance à travers la membrane cellulaire, dans: Manuel de physiologie médicale, 13e éd, AC Guyton, JE Hall (éd.). Philadelphie, Elsevier Inc., 2016.
- Lodish H, Berk A, Zipursky SL, Matsudaira P, Baltimore D, Darnell J: Transport à travers les membranes des cellules, dans: Molecular and Cell Biology, 4e ed.
- Nelson, D. L., Lehninger, un. L., & Cox, M. M. (2008). Principes de lehninger de la biochimie. Macmillan.
- Alberts, B., Bray, D., Hopkin, k., Johnson, un. D., Lewis, J., Raff, m.,… & Walter, P. (2013). Biologie cellulaire essentielle. Garland Science.
- « Caractéristiques Soma Parties et fonctions
- MAISONS (COTINIS MUTABILIS) Caractéristiques, habitat, reproduction »

