Bicarbonate de calcium

- 2926
- 313
- Raphaël Meyer
 Le bicarbonate de calcium est un sel inorganique du groupe bicarbonate
Le bicarbonate de calcium est un sel inorganique du groupe bicarbonate Qu'est-ce que le bicarbonate de calcium?
Il bicarbonate de calcium C'est un sel inorganique avec une formule chimique CA (HCO3)2. Il provient de la nature du carbonate de calcium présent dans le calcaire et les pierres minérales telles que la calcite.
Le bicarbonate de calcium est plus soluble dans l'eau que le carbonate de calcium. Cette caractéristique a permis la formation de systèmes karstiques dans les roches de calcaire et dans la structuration des grottes.
Les eaux souterraines qui traversent les fissures sont saturées dans leur déplacement de dioxyde de carbone (CO2).
Ces eaux érodent les roches de calcaire libérant du carbonate de calcium (CACO3) Ce bicarbonate de calcium se formera, selon la réaction suivante:
Voleur3(S) + CO2(g) + h2Ou (l) => ca (HCO3)2(aq)
Cette réaction se produit dans les grottes d'où proviennent les eaux très dures. Le bicarbonate de calcium n'est pas à l'état solide mais dans une solution aqueuse, avec le CA2+, Bicarbonate (HCO3-) et l'ion carbonate (CO32-).
Par la suite, en diminuant la saturation du dioxyde de carbone dans l'eau, la réaction inverse se produit, c'est-à-dire la transformation du bicarbonate de calcium en carbonate de calcium:
CA (HCO3)2(aq) => CO2 (g) + h2Ou (l) + caco3 (S)
Le carbonate de calcium est peu soluble dans l'eau, cela provoque sa précipitation comme un solide. La réaction précédente est très importante dans la formation de stalactites, de stalagmites et d'autres épaisses dans les grottes.
Ces structures rocheuses sont formées à partir des gouttes d'eau qui tombent du plafond des grottes. Le caco3 présents dans les gouttes d'eau est cristallisée pour former les structures susmentionnées.
Le fait de ne pas trouver de bicarbonate de calcium à l'état solide a gêné son utilisation, en trouvant peu d'exemples à cet égard.
Structure du bicarbonate de calcium
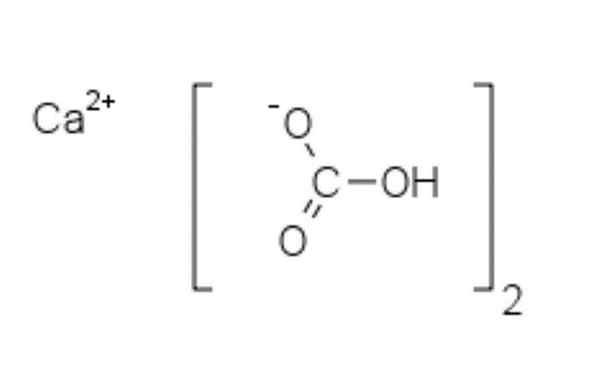 Structure chimique du bicarbonate de calcium
Structure chimique du bicarbonate de calcium Dans l'image supérieure, deux anions HCO sont affichés3- et un cation2+ interagissant électrostatiquement. La CA2+, Selon l'image, il devrait être situé au milieu, puisque HCO3- Ils ne se repousseraient pas pour leurs charges négatives.
La charge négative dans le HCO3- Il déménage entre deux atomes d'oxygène, par résonance entre le groupe carbonyle c = o et le lien C-O-; Pendant son séjour à CO32-, Ceci est déplacé entre les trois atomes d'oxygène, car la liaison C-O n'est pas protégée et peut recevoir une charge de résonance négative.
Il peut vous servir: diphénylamineLes géométries de ces ions peuvent être considérées comme des sphères de calcium entourées de triangles de carbonate plats avec une extrémité hydrogénée. En termes de rapport de taille, le calcium est remarquablement plus petit que les ions HCO3-.
Solutions aqueuses
Bicarbonate de calcium Vous ne pouvez pas former des solides cristallins, et il se compose vraiment de solutions aqueuses de ce sel. En eux, les ions ne sont pas seuls, comme à l'image, mais entourés de molécules H2SOIT.
Chaque ion est entouré d'une sphère d'hydratation, qui dépendra du métal, de la polarité et de la structure des espèces dissous.
La CA2+ Il se coordonne avec les atomes d'oxygène de l'eau pour former un aquocomplex, CA (OH2)n2+, où n est généralement considéré comme six; c'est-à-dire un "octaèdre aqueux" autour du calcium.
Alors que HCO Anions3- Ils interagissent bien, soit avec des ponts d'hydrogène (ou2Co-h-oh2) ou avec les atomes d'hydrogène de l'eau dans le sens de la charge négative (hoco2- H-OH, interaction dipolaire).
Ces interactions entre le CA2+, HCO3- Et l'eau est si efficace qu'ils rendent le bicarbonate de calcium très soluble dans ce solvant; Contrairement au carbonate de calcium (Caco3), dans lequel les attractions électrostatiques entre le CA2+ et le CO32- Ils sont très forts, précipitant la solution aqueuse.
En plus de l'eau, il y a des co-molécules2 autour, qui réagissent lentement pour contribuer plus de hco3- (Selon les valeurs de pH).
Solide hypothétique
Jusqu'à présent, les tailles d'ions et les charges dans le bicarbonate de calcium, ni la présence d'eau, expliquent pourquoi il n'y a pas de composé solide; c'est-à-dire des cristaux purs qui peuvent être caractérisés par une cristallographie x-rayon. Le bicarbonate de calcium n'est rien de plus que des ions présents dans l'eau à partir de laquelle les formations caverneuses continuent de croître.
Oui ca2+ Et le HCO3- Ils pourraient s'isoler de l'eau en évitant la réaction chimique suivante:
CA (HCO3)2(aq) → Caco3(S) + CO2(g) + h2Ou (l)
Ensuite, ceux-ci pourraient être regroupés en un solide cristallin blanc avec des proportions stœchiométriques 2: 1 (2HCO3/ 1ca).
Peut vous servir: 30 exemples de suspensions chimiquesIl n'y a pas d'études sur sa structure, mais elle pourrait être comparée à celle du bicarbonate de sodium (comme bicarbonate de magnésium, Mg (HCO3)2, Il n'existe pas non plus comme solide), ni avec celui du carbonate de calcium.
Stabilité: bicarbonate de sodium (NAHCO3) contre. Bicarbonate de calcium (CA (HCO3)2)
Le bicarbonate de sodium cristallise dans le système monoclinique et le bicarbonate de calcium dans les systèmes trigonaux (calcite) et ortorrombiques (aragonite).
Si le na est remplacé+ pour le CA2+, Le réseau cristallin serait déstabilisé par la plus grande différence de tailles; c'est-à-dire le na+ Pour être plus petit, il forme un verre plus stable avec le HCO3- par rapport au CA2+.
En fait, le CA (HCO3)2(aq) a besoin d'eau pour s'évaporer afin que ses ions puissent être regroupés en verre; Mais le réseau cristallin de ceci n'est pas assez fort pour le faire à température ambiante. Lors du chauffage de l'eau, la réaction de décomposition se produit (équation d'en haut).
Être l'ion na+ En solution, cela formerait le verre avec le HCO3- Avant sa décomposition thermique.
La raison pour laquelle alors pourquoi le bicarbonate de calcium ne cristallise pas (théoriquement), est due à la différence des radios ou tailles ioniques de leurs ions, qui ne peuvent pas former un cristal stable avant leur décomposition.
Bicarbonate de calcium (CA (HCO3)2) contre. carbonate de calcium (CACO3)
Si d'un autre côté, h est ajouté+ Aux structures cristallines du carbonate de calcium, ils changeraient radicalement leurs propriétés physiques. Peut-être que leurs points de fusion tombent considérablement, et même les morphologies des cristaux se terminent modifiées.
Proprietes physiques et chimiques
Formule chimique
CA (HCO3)2
Poids moléculaire
162.11 g / mol
État physique
Il n'apparaît pas à l'état solide. Il se trouve dans une solution aqueuse, et lorsque la chaleur est appliquée pour s'évaporer, il devient du carbonate de calcium.
Solubilité dans l'eau
16,1 g / 100 ml à 0º C; 16,6 g / 100 ml à 20 ° C et 18,4 g / 100 ml à 100 ° C.
Ces valeurs indiquent une grande affinité des molécules d'eau par les ions du bicarbonate de calcium, comme expliqué dans la section précédente. Pendant ce temps, seulement 15 mg de carbonate de calcium se dissolvent dans un litre d'eau, ce qui reflète ses fortes interactions électrostatiques.
Parce que le bicarbonate de calcium ne peut pas former un solide, sa solubilité ne peut pas être déterminée expérimentalement.
Cependant, étant donné les conditions créées par le CO2 Dissous dans l'eau qui entoure le calcaire, la masse de calcium dissoute à une température t pourrait être calculée; masse qui serait égale à la concentration de bicarbonate de calcium.
Peut vous servir: acide benzyique: synthèse, transposition et utilisationsÀ différentes températures, la masse dissous augmente comme indiqué dans les valeurs à 0, 20 et 100 ° C. Ensuite, selon ces expériences, il est déterminé à quelle quantité de bicarbonate de calcium Il se dissout au voisinage du carbonate de calcium, dans un milieu aqueux gazéifié avec du CO2.
Une fois que le CO s'échappe2 Le carbonate de calcium gazeux se précipitera, mais pas le bicarbonate de calcium.
Points de fusion et d'ébullition
Le réseau cristallin du CA (HCO3)2 C'est beaucoup plus faible que celui du caco3. S'il pouvait être obtenu à l'état solide et mesure la température à laquelle il fond dans une source, une valeur serait sûrement obtenue bien en dessous de 899 ° C. De même, il faut s'y attendre pour déterminer le point d'ébullition.
Point de combustion
Ce n'est pas du carburant.
Des risques
Étant donné que ce composé n'existe pas solidement, il est peu probable qu'il représente un risque de manipuler ses solutions aqueuses, car les deux ions CA2+ Comme HCO3- Ils ne sont pas nocifs pour les faibles concentrations; Et par conséquent, le plus grand risque, qui serait d'ingestion de telles solutions, ne pourrait être due qu'à une dose dangereuse de calcium ingéré.
Si le composé formait un solide, même peut-être physiquement différent du caco3, Ses effets toxiques ne pouvaient pas aller au-delà de l'inconfort et de la résection simples après contact physique ou inhalation.
Applications
- Les solutions de bicarbonate de calcium sont utilisées depuis longtemps pour laver les articles anciens, en particulier les œuvres d'art ou des documents historiquement importants.
- Des solutions de bicarbonate ont été utilisées dans la prévention de l'ostéoporose. Cependant, dans un cas, des effets secondaires tels que l'hypercalcémie, l'alcalose métabolique et l'insuffisance rénale ont été observés dans un cas.
- Le bicarbonate de calcium est donné, parfois, par voie intraveineuse pour corriger l'effet dépressif de l'hypokaliémie sur le fonctionnement cardiaque.
- Il est utilisé pour calmer l'acidité de l'estomac.
Les références
- Wikipedia (2018). Bicarbonate de calcium. Pris de: dans.Wikipédia.org
- Sirah Dubois (3 octobre 2017). Qu'est-ce que le bicarbonate de calcium? Récupéré de: Livestrong.com
- Science Learning Hub (2018). Chimie du carbonate. Récupéré de: scientifique.org.NZ
- PubChem (2018). Bicarbonate de calcium. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement

