Historique du soufre, propriétés, structure, obtention, utilisations

- 1848
- 170
- Louna Baron
Il soufre C'est un élément non métallique qui mène, en dessous de l'oxygène, le groupe de calcogens dans le tableau périodique. Il est spécifiquement situé dans le groupe 16 avec la période 3, et est représenté avec les symboles chimiques S. De ses isotopes naturels, le 32S dort beaucoup (environ 94% de tous les atomes de soufre).
C'est l'un des éléments les plus abondants de la Terre, composant environ 3% de sa masse totale. C'est-à-dire que si tout le soufre de la planète était pris, deux lunes jaunes pouvaient être construites; Il y aurait trois satellites au lieu d'un. Il peut adopter plusieurs états d'oxydation (+2, -2, +4 et +6), de sorte que leurs sels sont nombreux et enrichissent le cortex terrestre et le noyau terrestre.
 Cristaux de soufre. Source: Pixabay.
Cristaux de soufre. Source: Pixabay. Le soufre est synonyme de jaune, de mauvaises odeurs et de l'enfer. La raison principale de ses mauvaises odeurs est due à ses composés dérivés; en particulier gazeux et organique. Parmi les autres, leurs minéraux sont solides et ont des couleurs qui incluent le jaune, le gris, le noir et le blanc (entre autres).
C'est l'un des éléments qui présente le plus un grand nombre d'alotropes. Il peut être trouvé comme de petites et des molécules discrètes de S2 ou s3; comme anneaux ou cycles, étant orthorrombique et monoclinique soufre S8 le plus stable et le plus abondant de tous; Et comme chaînes hélicoïdales.
Non seulement il est trouvé dans le cortex terrestre sous forme de minéraux, mais aussi dans les matrices biologiques de notre corps. Par exemple, il se trouve en acides aminés cystines, cystéine et méthionine, dans les protéines de fer, de kératine et de vitamines. Il est également présent dans l'ail, les pamplemousses, les oignons, le chou, le brocoli et le cauliflor.
Chimiquement c'est un élément doux, et en l'absence d'oxygène forment des minéraux et des sulfates sulfuro. Brûle avec une flamme bleuâtre et peut être représenté comme un solide amorphe ou cristallin.
Bien qu'il soit indispensable pour la synthèse de l'acide sulfurique, de la substance hautement corrosive et de l'attribution des odeurs désagréables, c'est en fait un élément bénin. Le soufre peut être stocké dans n'importe quel espace sans précautions majeures, tant que les incendies sont évités.
[TOC]
Histoire du soufre
Dans la Bible
Le soufre est l'un des plus anciens éléments de l'histoire de l'humanité; À tel point que sa découverte est incertaine et on ne sait pas lequel des anciennes civilisations l'a utilisé pour la première fois (4000 ans avant le Christ). Dans les mêmes pages de la Bible, vous pouvez le trouver accompagnant le feu infernal et les pannes.
On pense que l'odeur présumée de l'enfer a à voir avec les éruptions volcaniques. Son premier découvreur devait sûrement courir dans des mines de cet élément alors que la poussière atterrit ou les cristaux jaunes à proximité d'un volcan.
Antiquité
Ce solide jaunâtre a rapidement démontré des effets de guérison notables. Par exemple, les Égyptiens ont utilisé du soufre pour traiter les inflammations des paupières. Il a également soulagé la gale et l'acné, une application qui peut être vue aujourd'hui dans les savons en soufre et autres éléments dermatologiques.
Les Romains ont utilisé cet élément dans leurs rituels, comme le fumigante et le blanchiment. Quand la bibliothèque SOS2, Le gaz qui a inondé les pièces se mélangeant à l'humidité et fournissant un milieu antibactérien et capable d'anéantir les insectes.
Les Romains, comme les Grecs, ont découvert la forte combustibilité du soufre, il est donc devenu synonyme de feu. La couleur de ses flammes bleuâtre devait éclairer les cirques romains. On pense que les Grecs, quant à eux, ont utilisé cet élément pour créer des armes incendiaires.
Les Chinois de leur côté ont appris que le mélange de soufre avec du salpêtre (KNO3) et le charbon ont créé la poudre à canon noire qui a payé un chiffre d'affaires historique, et qui a été suscité dans les nations de grandes exigences et intérêts pour ce minéral.
Il peut vous servir: circonium: histoire, propriétés, structure, risques, utilisationsLes temps modernes
Comme si la poudre à canon n'était pas une raison suffisante pour convoiter le soufre, l'acide sulfurique et les applications industrielles ont rapidement émergé. Et avec la baguette d'acide sulfurique, la quantité de richesse ou de prospérité d'un pays par rapport à ses niveaux de consommation de ce composé a été mesurée.
Ce n'est qu'en 1789 que le brillant chimiste Antoine Lavoisier a pu reconnaître le soufre et le classer comme un élément. Puis, en 1823, le chimiste allemand Eilhard Mitscherlich a découvert que le soufre peut se cristalliser principalement de deux manières: Rhomboédrica et monoclinique.
L'histoire du soufre a suivi le même canal de ses composés et applications. Avec l'énorme importance industrielle de l'acide sulfurique, il a accompagné la vulcanisation des caoutchoucs, la synthèse de la pénicilline, l'exploitation minière, le raffinage des crus d'huile riches en soufre, la nutrition du sol, etc.
Propriétés
Apparence physique
Brise solide dans la poussière ou les cristaux. Sa couleur est le jaune citron opaque, il est insipide et manque d'odeur.
Apparence liquide
Le soufre liquide est singulier car sa couleur jaune initiale devient rougeâtre et s'intensifie et s'assombrit si elle subit des températures élevées. Quand il brûle, disons des flammes bleues et brillantes.
Masse molaire
32 g / mol.
Point de fusion
115.21 ° C.
Point d'ébullition
445ºC.
point d'allumage
160 ° C.
Température d'auto-signification
232 ° C.
Densité
2,1 g / ml. Cependant, d'autres alotropes peuvent être moins denses.
Capacité thermique molaire
22,75 J / mol · k
Radio-covalent
105 ± 3 h.
Électronégativité
2.58 sur l'échelle Pauling.
Polarité
Les liaisons S-S sont apolaires car les deux atomes de soufre ont la même électronégativité. Cela rend tous ses alotropes, cycliques ou sous forme de chaînes, être apolaires; Et par conséquent, ses interactions avec l'eau sont inefficaces et ne peuvent pas y être solubilisées.
Cependant, le soufre peut être dissous dans des solvants apolaires tels que le disulfure de carbone, CS2, et aromatique (benzène, toluène, xylène, etc.).
Ions
Le soufre peut former plusieurs ions, généralement des anions. Le plus connu de tous est le sulfure, S2-. Le s2- Il se caractérise par un volume et une base douce de Lewis.
Pour être une base douce, la théorie établit qu'il aura tendance à former des composés avec des acides mous; Comme des cations de métal de transition, y compris la foi2+, PB2+ et cu2+.
Structure et configuration électroniques
La couronne de soufre
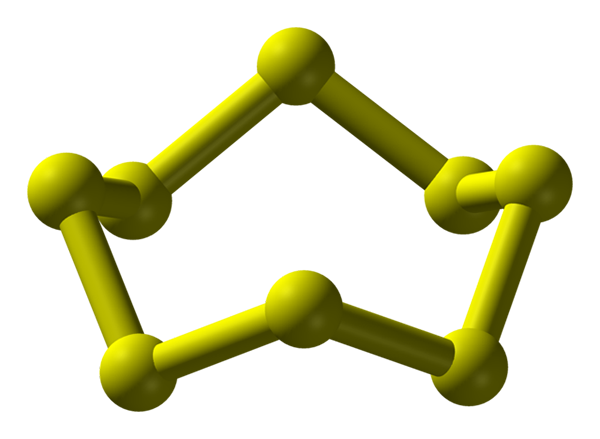 Molecule S8, la plus stable et la plus abondante alotrope du soufre. Source: Benjah-bmm27.
Molecule S8, la plus stable et la plus abondante alotrope du soufre. Source: Benjah-bmm27. Le soufre peut se produire dans une grande variété d'alotropes; et ceux-ci ont à leur tour des structures cristallines qui sont modifiées sous différentes pressions et / ou températures. Par conséquent, le soufre est un élément riche en alotropos et polymorphes, et l'étude de ses structures solides représente une source infinie d'œuvres théoriques-expérimentales.
Pourquoi une telle complexité structurelle? Pour commencer, les liaisons covalentes dans le soufre (S-S) sont très fortes, ne sont surmontées que par le carbone, le c-c et par l'hydrogène, H-H.
Le soufre, contrairement au carbone, n'a pas tendance à former des tétraèdres mais des boomerangs; qu'avec leurs angles, ils se replient et sonnent pour stabiliser les chaînes de soufre. L'anneau le plus connu de tous, représentant également le plus stable alotrope du soufre, est le S8, La "couronne de soufre" (image supérieure).
Notez que tous les liens S-S8 Ils semblent des boomerangs individuels, résultant en un anneau avec des plis et des plans du tout. Ces couronnes s8 Ils interagissent à travers les forces de Londres, orientées de telle manière qu'ils parviennent à créer des modèles structurels qui définissent un cristal ortorrombique; appelé s8 α (S-α, ou simplement soufre ortorrombique).
Peut vous servir: matériaux élastiquesPolymorphes
La couronne de soufre est l'un des nombreux alotropes de cet élément. Le s8 α est un polymorphe de cette couronne. Il y en a deux autres (parmi les plus importants) appelés S8 β et S8 γ (S-β et S-γ, respectivement). Les deux polymorphes cristallisent dans les structures monocliniques, étant le s8 γ est plus dense (soufre gamma).
Les trois sont des solides jaunes. Mais comment chaque polymorphe est-il obtenu séparément?
Le s8 β prépare le s8 α à 93 ° C, puis permettant à son refroidissement lent de ralentir sa transition de retour vers la phase ortorrombique (le α). Et le S8 γ, en revanche, est obtenu lorsqu'il est basé8 α à 150 ° C, permettant à nouveau de refroidir lentement; C'est la plus dense des polymorphes de la couronne de soufre.
Autres alotropes cycliques
La couronne s8 Ce n'est pas le seul alotrope cyclique. Il y en a d'autres tels que S4, S5 (Analogique à cyclopentano), s6 (représenté par un hexagone ainsi que le cycle), S7, S9, et s10-20; Ce dernier signifie qu'il peut y avoir des anneaux ou des cycles contenant de dix à vingt atomes de soufre.
Chacun d'eux représente différents alotrochs cycliques de soufre; Et à son tour, pour le souligner, ils ont des variétés de polymorphes ou de structures polymorphes qui dépendent de la pression et de la température.
Par exemple, le s7 Il a jusqu'à quatre polymorphes connus: α, β, γ et δ. Les membres ou les couronnes de masses moléculaires plus élevées sont des produits de synthèse organique et ne prédominent pas de nature.
Chaînes de soufre
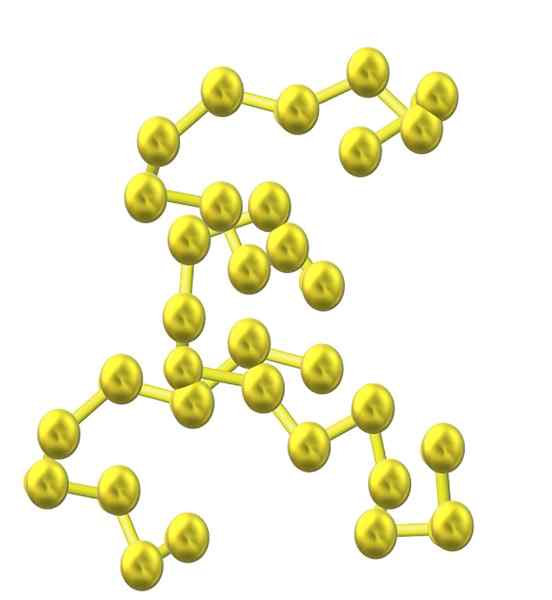 Chaîne de soufre. Source: Opensentax [CC par 4.0 (https: // CreativeCommons.Org / licences / par / 4.0)]
Chaîne de soufre. Source: Opensentax [CC par 4.0 (https: // CreativeCommons.Org / licences / par / 4.0)] À mesure que davantage d'atomes de soufre sont incorporés dans la structure, leur tendance à sonner diminue et que les chaînes de soufre restent ouvertes et adoptent des conformations hélicoïdales (comme s'il s'agissait de spirales ou de vis).
Et ainsi, une autre famille volumineuse de soufre alotrops survient qui ne consiste pas en anneaux ou cycles mais en chaînes (comme l'image supérieure).
Lorsque ces chaînes S-S s'alignent en parallèle au verre, elles captent des impuretés et finissent par définir un solide fibreux appelé soufre fibreux, ou S-ψ. Si parmi ces chaînes parallèles, il existe des liaisons covalentes qui les interconnectent (comme avec la vulcanisation du caoutchouc), nous avons le soufre laminaire.
Lorsque le soufre8 Il fait fondre une phase liquide jaunâtre qui peut devenir sombre si la température augmente. En effet.
Ce liquide en cas de refroidissement montre les caractéristiques plastiques puis vitreuses; c'est-à-dire qu'un soufre vitré et amorphe (s-were) sont obtenus. Sa composition se compose à la fois des anneaux et des chaînes de soufre.
Et lorsqu'un mélange de l'alotrope fibreux et laminaire est obtenu à partir du soufre amorphe, un produit commercial utilisé pour la vulcanisation du caoutchouc.
Petits alotropes
Bien qu'ils soient laissés en dernier, ils ne sont pas moins importants (ou intéressants) que les alotropos des plus grandes masses moléculaires. S2 et s3 sont les versions sulfurisées de l'O2 je3. Dans les deux premiers atomes de soufre, ils se joignent à une double liaison, s = s, et dans la seconde, il y a trois atomes avec des structures de résonance, s = s-s.
Les deux S2 comme le s3 Ils sont gazeux. Le s3 Manifester une coloration rouge cerise. Les deux ont suffisamment de matériel bibliographique pour chaque couverture d'un article individuel.
Configuration électronique
La configuration électronique de l'atome de soufre est:
[NE] 3S2 3p4
Vous pouvez gagner deux électrons pour compléter votre octeto de Valence, et donc avoir un état d'oxydation de -2. De même, vous pouvez perdre des électrons, en commençant par deux dans ses orbitales 3p, étant son état d'oxydation de +2; Si vous perdez deux autres électrons, avec vos orbitales 3p vides, votre statut d'oxydation sera +4; Et si vous perdez tous les électrons, ce sera +6.
Peut vous servir: métalloïdesObtenir où est le soufre?
Minéralogique
Le soufre fait partie de nombreux minéraux. Parmi eux se trouvent la pyrite (fes2), La Galena (PBS), Covellita (Cus) et autres minéraux de sulfate et de sulfures. En les traitant, non seulement les métaux peuvent être extraits, mais aussi le soufre après une série de réactions réductrices.
Il peut également être obtenu uniquement dans des évents volcaniques, où lorsque la température est augmentée et se déverse; Et s'il se feuille, il ressemblera à une lave bleuâtre. Grâce à un travail ardu et à des travaux physiques intenses, le soufre peut être collecté comme cela a été fait assez souvent en Sicile.
Le soufre peut également être trouvé dans les mines souterraines, qui sont conçues pour pomper l'eau surchauffante pour fondre et la transférer à la surface. Ce processus d'obtention est connu sous le nom de processus Brasch, actuellement peu utilisé.
Pétrole
Aujourd'hui, la majeure partie du soufre provient de l'industrie pétrolière, car ses composés organiques font partie de la composition de l'huile brut de l'huile et de ses dérivés raffinés.
Si un brut ou un produit raffiné est riche en soufre et subit une hydrodésulfurisation, il libèrera de grandes quantités de H2S (gaz puant qui sent les œufs pourris):
R-S-R + 2 H2 → 2 Rh + H2S
Puis h2S Il est chimiquement dans le processus Clauss, résumé avec les équations chimiques suivantes:
3 o2 + 2 h2S → 2 SO2 + 2 h2SOIT
Swin2 + 2 h2S → 3 S + 2 H2SOIT
Applications
Certaines des utilisations du soufre sont mentionnées ci-dessous et généralement:
- C'est un élément essentiel pour les plantes et les animaux. Il est même présent dans deux acides aminés: cystéine et méthodin.
- Il s'agit de la matière première de l'acide sulfurique, composée dans la préparation d'innombrables produits commerciaux.
- Dans l'industrie pharmaceutique, il est destiné à la synthèse des dérivés de soufre, la pénicilline étant la plus connue des exemples.
- Permet la vulcanisation des caoutchoucs en interconnectant les chaînes polymères avec des liens S-S.
- Sa couleur jaune et ses mélanges avec d'autres métaux le rendent souhaitable dans l'industrie des pigments.
- Mélangé avec une matrice inorganique, comme le sable et les rochers, l'asphalte en béton et en soufre est préparé pour le remplacement du bitume.
Risques et précautions
Le soufre à elle seule est une substance non toxique inoffensive et représente également des risques potentiels, à moins de réagir pour former d'autres composés. Ses sels de sulfate ne sont pas dangereux et peuvent être manipulés sans précautions majeures. Cela ne se produit pas, cependant, avec ses dérivés gazeux: donc2 et h2S, tous deux extrêmement toxiques.
S'il est en phase liquide, cela peut provoquer de graves brûlures. Si vous engloutiez en grande quantité, H peut déclencher2S dans l'intestin. Pour le reste, il ne représente aucun risque pour ceux qui mâchent.
En termes généraux, le soufre est un élément sûr qui ne nécessite pas trop de précautions, sauf l'éloigner du feu et des agents oxydants forts.
Les références
- Fhiver & Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Laura Crapanzano. (2006). Polymorphisme du soufre: aspects structurels et dynamiques. Physique [physique].Université Joseph - Fourier - Grenoble I. Anglais. FFTEL-00204149F
- Wikipédia. (2019). Allotropes de soufre. Récupéré de: dans.Wikipédia.org
- Meyer Beat. (1976). Soufre élémentaire. Revues chimiques, Vol. 76, non. 3.
- Docteur. Doug Stewart. (2019). Faits d'élément de soufre. Chimicool. Récupéré de: Chemicool.com
- Donald W. Davis et Randall A. Detro. (2015). Histoire du soufre. Georgia Gulf Sulfur Corporation. Récupéré de: Georgiagulfsulfur.com
- Helmestine, Anne Marie, Ph.D. (11 janvier 2019). 10 faits de soufre intéressants. Récupéré de: Thoughtco.com
- Boone, C.; Bond, C.; Hallman, un.; Jenkins, J. (2017). Fiche d'information générale du soufre; Centre national d'information sur les pesticides, Oregon State University Extension Services. NPIC.ORST.Édu
- « Indépendance des causes du Mexique, développement, conséquences, personnages
- Flore et faune des espèces représentatives de Jalisco »

