Histoire de l'arsenic, structure, propriétés, utilisations

- 4742
- 1147
- Mlle Ambre Dumont
Il arsenic C'est un semi-métal ou métalloïde qui appartient au groupe 15 ou qui va du tableau périodique. Il est représenté par le symbole chimique comme, et a le numéro atomique 33. Il peut être sous trois formes allotropes: jaune, noir et gris; Ce dernier étant le seul avec une importance industrielle.
L'arsenic gris est un solide métallique et à l'amitié fragile, avec une couleur d'acier et cristalline (image inférieure). Perd sa luminosité lorsqu'elle est exposée à l'oxyde d'arsenioso formant l'air (comme2SOIT3), qui, lorsqu'il est chauffé, émet une odeur d'ail. D'un autre côté, ses alotrochos jaunes et noirs sont respectivement moléculaires et amorphes,.
 Arsenic métallique. Source: Images haute résolution d'éléments chimiques [CC par 3.0 (https: // CreativeCommons.Org / licences / par / 3.0)]
Arsenic métallique. Source: Images haute résolution d'éléments chimiques [CC par 3.0 (https: // CreativeCommons.Org / licences / par / 3.0)] L'arsenic est situé dans la croûte terrestre associée à de nombreux minéraux. Seule une petite proportion est dans un état d'origine, mais associée à l'antimoine et à l'argent.
Parmi les minéraux les plus courants dans lesquels l'arsenic est ce qui suit figure: Rejalgar (comme4S4), l'oropiment (comme2S3), Loellingita (laid2) et l'enargita (Cu3Cul4). L'arsenic est également obtenu comme produit collatéral de la fonderie de métaux tels que le plomb, le cuivre, le cobalt et l'or.
Les composés de l'arsenic sont toxiques, en particulier Arsina (cendres3). Cependant, l'arsenic possède de nombreuses applications industrielles, y compris l'alliage avec plomb, utilisées dans l'élaboration des batteries de voiture, et l'alliage avec le gallium avec plusieurs utilisations en électronique.
[TOC]
Historique de votre découverte
Le nom «de l'arsenic» vient du latin arsenicum et de l'arsenikon grec, se référant à l'oropiment jaune, qui constituait la principale forme d'utilisation de l'arsenic par les alchimistes.
L'arsenic bien avant d'être reconnu comme un élément chimique, était connu et utilisé sous la forme de ses composés. Par exemple, Aristote au IVe siècle.C. Il a écrit sur le Sandarache, une substance qui pense maintenant que c'était du sulfure d'arsenic.
Plinio El Viejo et Pivanio Discorides, au 1er siècle.C., Ils ont décrit l'oropiment, un minéral constitué par2S3. Au XIe siècle, trois espèces d'arsenic étaient reconnues: blanc (comme4SOIT4), Le jaune (comme2S3) et rouge (comme4S4).
L'arsenic en tant qu'élément pur, a été observé pour la première fois par Albertus Magnus (1250). Magnus chauffé sulfure d'arsenic avec du savon, remarquant l'apparition d'une substance avec une caractéristique similaire à l'image gris-gris de l'image. Cependant, le premier rapport authentique de son isolement a été publié en 1649 par Johann Schroeder, un pharmacien allemand.
Schroeder a préparé de l'arsenic en chauffant son oxyde de charbon. Par la suite, Nicolas Lémery a réussi à le chauffer en chauffant un mélange d'oxyde d'arsenic, de savon et de potasse. Au XVIIIe siècle, cet élément a finalement été reconnu comme semi-métal.
Il peut vous servir: pas d'électrolytes: caractéristiques et exemplesStructure d'arsenic
L'arsenic est isomorphe à l'antimoine; C'est structurellement, ils sont identiques, ne diffèrent que par la taille de leurs atomes. Chaque atome d'arsenic forme trois liaisons covalentes en tant que manière de telle manière qu'elles créent également des unités hexagonales6 "Ridé ou raide", car l'hybridation des atomes As est SP3.
Puis les unités6 Ils se connectent en donnant naissance à des couches d'arsenic abruptes, qui interagissent faiblement les uns avec les autres. Suivant leurs forces intermoléculaires, principalement dépendantes de leurs masses atomiques, les cristaux rhomnéniques d'arsenic gris donnent au solide une texture fragile et cassante.
Peut-être en raison des répulsions des électrons de l'arsenic, les unités6 Formé entre les couches parallèles ne définissent pas un octaèdre parfait mais déformé:
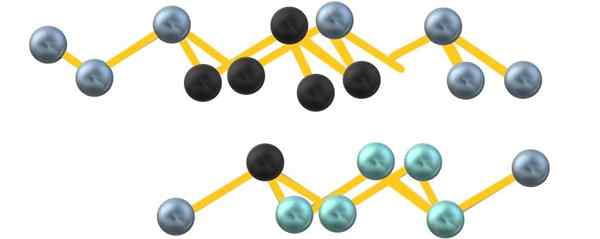 Structure cristalline d'arsenic gris. Source: Gabriel Bolívar.
Structure cristalline d'arsenic gris. Source: Gabriel Bolívar. Notez que les sphères noires attirent le plan déformé dans l'espace entre deux couches abruptes. De plus, dans la couche ci-dessous, il y a des sphères bleuâtre qui, à côté de la sphère noire, composent l'unité6 mentionné au début de la section.
La structure semble ordonnée, les rangées s'élèvent et descendent, et est donc cristalline. Cependant, vous pouvez devenir amorphe, avec des sphères pressées de différentes manières. Lorsque l'arsenic grisâtre devient amorphe, il devient un semi-conducteur.
Arsenic jaune
L'arsenic jaune, le plus toxique alotrope de cet élément, est un simple solide moléculaire. Se compose de molécules4 unités par faibles forces de dispersion, qui ne les empêchent pas de volatiliser.
Arsenic noir
L'arsenic noir est amorphe; Mais pas comment l'alotrope grisâtre peut-il être. Sa structure est légèrement similaire à la récente6 Ils ont de plus grandes zones et différents modèles de troubles.
Configuration électronique
[Ar] 3ddix4s24p3
A toutes les orbitales de niveau 3 complet. Formation de liens utilisant des orbitales 4S et 4P (ainsi que 4D) par différentes hybridations chimiques.
Propriétés
Poids moléculaire
74 922 g / mol
Description physique
L'arsenic gris est un solide métallique grisâtre et une consistance fragile.
Couleur
Trois formes allotropes, jaune (alpha), noir (bêta) et gris (gamma).
Odeur
Toilettes
Saveur
Insipide
Point de fusion
1.090 K à 35,8 atm (triple point d'arsenic).
À la pression normale n'a pas de point de fusion, car il sublime 887 K.
Densité
-Arsenic gris: 5,73 g / cm3.
Il peut vous servir: groupe carbonyle: caractéristiques, propriétés, nomenclature, réactivité-Arsenic jaune: 1,97 g / cm3.
Solubilité dans l'eau
Insoluble
Radio atomique
139h
Volume atomique
13,1 cm3/ mol
Radio-covalent
120 h
Chaleur spécifique
0,328 J / g · mol à 20 ºC
Chaleur d'évaporation
32,4 kJ / mol
Électronégativité
2,18 sur l'échelle Pauling
Énergie d'ionisation
Première énergie d'ionisation 946,2 kJ / mol
États d'oxydation
-3, +3, +5
La stabilité
L'arsenic élémentaire est stable dans l'air sec, mais lorsqu'il est exposé à l'air humide, il est recouvert d'une couche de bronze jaune qui peut devenir une couche noire d'oxyde d'arsenic (2SOIT3).
Décomposition
Lorsque l'arsenic est chauffé à la décomposition, il émet une fumée blanche2SOIT3. La procédure est dangereuse car Arsina peut également être émise, un gaz très toxique.
Auto-direction
180 ºC
Dureté
3.5 sur l'échelle de dureté MOHS.
Réactivité
Il n'est pas attaqué par l'acide sulfurique froid ou l'acide chlorhydrique concentré. Réagit avec l'acide nitrique ou l'acide sulfurique chaud, formant l'acide arsenous et l'acide d'arsenic.
Lorsque l'arsenic gris est volatilisé par chauffage et que les vapeurs sont rapidement refroidies, un arsenic jaune est formé. Cela revient à la forme grisâtre, lorsqu'il est soumis à une lumière ultraviolette.
Applications
Alliages
Une petite quantité d'arsenic ajoutée pour plomb, durcit suffisamment ses alliages pour les utiliser dans la muqueuse des câbles et dans l'élaboration des batteries de voitures.
L'ajout d'arsenic au laiton, un alliage de cuivre et de zinc, augmente sa résistance à la corrosion. D'un autre côté, il corrige ou diminue la perte de zinc en laiton, ce qui provoque une augmentation de sa durée de vie utile.
électronique
L'arsenic purifié est utilisé dans la technologie des semi-conducteurs où elle est utilisée en conjonction avec Gallic.
Les GaAs ont un intervalle de bande directe, qui peut être utilisé dans la fabrication de diodes, de laser et de LED. En plus du gallium arseniuro, il existe d'autres arseniuros, tels que les arseniuro indiens et l'aluminium arseniuro, qui constituent également des semi-conducteurs II-V.
Pendant ce temps, le cadmium arseniuro est un semi-conducteur du type II-iv. Arsina a été utilisée dans le doping semi-conducteur.
Agriculture et conservation du bois
La plupart des applications ont été rejetées en raison de leur grande toxicité et de celle de leurs composés. Le comme2SOIT3 a été utilisé comme pesticide, tandis que l'as2SOIT5 C'est un ingrédient d'herbicides et d'insecticides.
Acide d'arsenic (h3ASO4) et des sels tels que le calcium et l'arséniate de plomb, ont été utilisés pour stériliser les sols et contrôler les ravageurs. Cela génère un risque de pollution de l'environnement avec l'arsenic.
Peut vous servir: éléments liquides: quels sont et des exemplesLe plomb arseniato a été utilisé comme insecticide dans les arbres fruitiers, jusqu'à la première moitié du XXe siècle. Mais en raison de sa toxicité, il a été remplacé par le méthylalarsénate de sodium, qui a cessé d'être utilisé pour la même raison depuis 2013.
Médicinal
Jusqu'au XXe siècle, plusieurs de leurs composés étaient utilisés comme médicaments. Arsfénamina et Neolsalvarsan, par exemple, ont été utilisés dans le traitement de la syphilis et de la triposomiase.
En 2000, l'utilisation de l'AS a été approuvée2SOIT3, Composé très toxique, dans le traitement de la promesse de promine-résistance aiguë à l'acide acide des transactions de rétino-trans. Récemment, l'isotope radioactif a été utilisé 74Quant à l'emplacement des tumeurs.
L'isotope produit de bonnes images, plus claire que celles obtenues avec le 124Moi, parce que l'iode est emmené à la thyroïde et produit du bruit dans le signal.
Autres utilisations
L'arsenic a été utilisé dans le passé comme alimentation additive dans la production de volaille et de porcs.
Il est utilisé comme catalyseur dans la fabrication d'oxyde d'éthylène. Il est également utilisé en pyrotechnie et en bronzage. L'oxyde d'Arsenioso est utilisé comme décolorant dans la fabrication de verre.
Où est-il situé?
L'arsenic peut être trouvé en petites quantités à l'état élémentaire, avec un degré élevé de pureté. Il est présent dans de nombreux composés, tels que: sulfures, arsenuros et sulfarseniuros.
Il se trouve également dans plusieurs minéraux, notamment: l'arsénopyrite (fesas), Loellingita (laid2), L'enargita (Cu3Cul4), l'oropiment (comme2S3) Et rejalgar (comme4S4).
Comment est-il obtenu?
Arsenopirita est chauffé à 650-700 ºC, en l'absence d'air. L'arsenic s'évapore, laissant du sulfure de fer (FES) comme résidu. Au cours de ce processus, l'arsenic se lie à l'oxygène à la forme4SOIT6, connu comme "l'arsenic blanc".
Le comme4SOIT6 Il est modifié pour former l'AS2SOIT3, dont les vapeurs sont collectées et condensées dans un ensemble de caméras en briques, de l'arsenic purifiant par sublimation.
La majeure partie de l'arsenic est produite en réduisant le carbone de la poussière formé à partir de2SOIT3.
Les références
- Stephen R. Marsden. (23 avril 2019). Chimie de l'arsenic. CHIMISTER BOOLISTexts. Récupéré de: Chem.Bibliothèque.org
- Helmestine, Anne Marie, Ph.D. (3 décembre 2018). Faits intéressants sur l'arsenic. Récupéré de: Thoughtco.com
- Wikipédia. (2019). Arsenic. Récupéré de: dans.Wikipédia.org
- Docteur. Pâte Stewart. (2019). Faits d'élément d'arsenic. Chimicool. Récupéré de: Chemicool.com
- Société royale de chimie. (2019). Arsenic. Récupéré de: RSC.Ou
- Les éditeurs d'Enyclopaedia Britannica. (3 mai 2019). Arsenic. Encyclopædia Britannica. Récupéré de: Britannica.com
- « Caractéristiques des groupes minoritaires, des types, des exemples
- Numéro de Reynolds à quoi sert, comment il est calculé, exerce »

