Alcool secondaire Qu'est-ce que la structure, les propriétés, les utilisations
- 3277
- 964
- Mlle Ambre Dumont
Qu'est-ce qu'un alcool secondaire?
UN alcool secondaire Il a le carbone en carbone du groupe hydroxyle (OH), attaché à deux carbones. Pendant ce temps, dans l'alcool primaire, le carbone en carbone du groupe hydroxyle est lié à un atome de carbone et dans l'alcool tertiaire attaché à trois atomes de carbone.
Les alcools sont des acides légèrement plus faibles que l'eau, avec la PKA suivante: eau (15,7); Les alcools méthyliques (15,2), l'éthyle (16), l'isopropyl (alcool secondaire, 17) et thermique (18). Comme on peut le voir, l'alcool isopropylique est moins acide que les alcools de méthyle et d'éthyle.
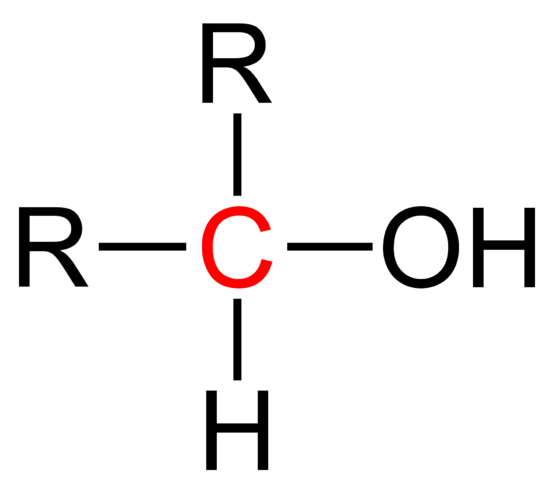
 Formule structurelle d'un alcool secondaire. Wikimedia Commons
Formule structurelle d'un alcool secondaire. Wikimedia Commons Dans l'image supérieure, la formule structurelle pour un alcool secondaire est montrée. Le carbone rouge est le porteur de OH et est lié à deux groupes alkyle (ou aryle) R et à un seul atome d'hydrogène.
Tous les alcools ont la formule générique ROH; Mais si le carbone du porteur est observé en détail, les alcools primaires sont obtenus (RCH2Oh), secondaire (r2Choh, élevé ici), et tertiaire (R3Coh). Ce fait fait une différence dans ses propriétés physiques et sa réactivité.
Structure d'un alcool secondaire
Les structures d'alcool dépendent de la nature des groupes R. Cependant, pour les alcools secondaires, certains exemplaires peuvent être faits, étant donné qu'il ne peut y avoir que des structures linéaires avec ou sans ramifications, ou des structures cycliques. Par exemple, vous avez l'image suivante:
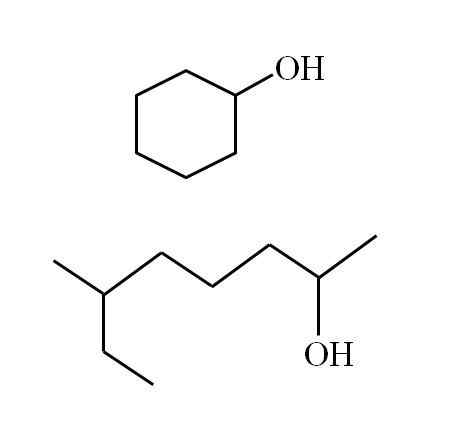 Un alcool secondaire cyclique et une autre chaîne ramifiée. Source: Gabriel Bolívar
Un alcool secondaire cyclique et une autre chaîne ramifiée. Source: Gabriel Bolívar Notez que pour les deux structures, il y a quelque chose en commun: oh est lié à un "V". Chaque extrémité du V représente un groupe égal (partie supérieure de l'image, structure cyclique) ou différente (partie inférieure, chaîne ramifiée).
De cette façon, tout alcool secondaire est très facilement identifié, même si sa nomenclature est inconnue du tout.
Propriétés
Points d'ébullition
Les propriétés des alcools secondaires ne diffèrent pas trop des autres alcools. Ce sont généralement des liquides transparents, et pour être solide à température ambiante, il doit former plusieurs ponts d'hydrogène et avoir une masse moléculaire élevée.
Il peut vous servir: acide perbromique (HBRO4): propriétés, risques et utilisationsCependant, la même formule structurelle R2Choh suggère certaines propriétés uniques en général pour ces alcools. Par exemple, le groupe OH est moins exposé et disponible pour les interactions des ponts d'hydrogène, R2Ch-oh-ohchr2.
En effet. En conséquence, les alcools secondaires ont des points d'ébullition plus bas que le primaire (RCH2OH).
Acidité
Selon la définition de Brönsted-Lowry, un acide est celui qui donne des protons ou des ions hydrogène, H+. Lorsque cela se produit avec un alcool secondaire, vous avez:
R2Choh + b- => R2Chou- + HB
Le conjugué Ras2Chou-, Anion alcoxyde, votre charge négative doit se stabiliser. Pour l'alcool secondaire, la stabilisation est plus faible car les deux groupes R ont une densité électronique, ce qui repousse la charge négative sur l'atome d'oxygène dans une certaine mesure.
Pendant ce temps, pour l'anion en alcoxyde d'un alcool primaire, RCH2SOIT-, Il y a moins de répulsion électronique ayant un seul groupe R et non deux. De plus, les atomes d'hydrogène n'exercent pas de répulsion significative, et au contraire, ils contribuent à stabiliser la charge négative.
Par conséquent, les alcools secondaires sont moins acides que les alcools primaires. Si tel est le cas, ils sont plus basiques et précisément pour les mêmes raisons:
R2Choh + h2B+ => R2Choh2+ + HB
Maintenant, les groupes R stabilisent la charge positive dans l'oxygène en donnant une partie de leur densité électronique.
Réactions
Hallogénide d'hydrogène et trihalogogénide de phosphore
Un alcool secondaire peut réagir avec un halogénide d'hydrogène. L'équation chimique de la réaction entre l'alcool isopropylique et l'acide bromhytérique est représentée sous un moyen d'acide sulfurique et de production de bromure d'isopropyle:
Ch3Chohch3 + Hbr => ch3Chbrch3 + H2SOIT
Et vous pouvez également réagir avec une trihalogogène de phosphore, px3 (X = br, i):
Il peut vous servir: Hydroxyde de nickel (iii): structure, propriétés, utilisations, risquesCh3-Choh-ch2-Ch2-Ch3 + Pbr3 => Ch3-chbr-ch2-Ch2-Ch3 + H3Pote3
Le produit chimique ci-dessus correspond à la réaction entre la section et le tribromure de phosphore, provoquant un bromure de pentil Sec.
Notez que dans les deux réactions, il y a un halogogénide d'alkyle secondaire (R2Chx).
Déshydratation
Dans cette réaction, un H et un OH de carbones voisins sont perdus, formant une double liaison entre ces deux atomes de carbone. Par conséquent, il y a la formation d'un alcène. La réaction nécessite un catalyseur acide et une alimentation thermique.
Alcool => alcène + h2SOIT
Vous avez par exemple la réaction suivante:
Cyclohexanol => cyclohexen + h2SOIT
Réaction avec les métaux actifs
Les alcools secondaires peuvent réagir avec les métaux:
Ch3-Choh-ch3 + K => cho3Chou-K+Ch3 + ½ h+
Ici, l'alcool isopropylique réagit avec le potassium pour former des ions d'isoproxyde de potassium et d'hydrogène.
Estérification
L'alcool secondaire réagit avec un acide carboxylique pour créer un ester. Par exemple, l'équation chimique de la réaction de l'alcool sechutilique est représentée avec de l'acide acétique, pour produire de l'acétate semi-butyle:
Ch3Chohch2Ch3 + Ch3COOH CH3Coochch3Ch2Ch3
Oxydation
Les alcools primaires oxydent les aldéhydos, et ceux-ci oxydent à leur tour les acides carboxyliques. Mais, les alcools secondaires oxydent de l'acétone. Les réactions sont généralement catalysées par le dichromate de potassium (k2Cro7) et l'acide chromique (H2Cro4).
La réaction globale est:
R2Choh => r2C = O
Nomenclature
Les alcools secondaires sont nommés en pointant la position du groupe OH dans la chaîne principale (plus). Ce numéro précède le nom, ou peut aller après le nom de l'alcane respectif pour ladite chaîne.
Par exemple, Cho3Ch2Ch2Ch2Chohch3, C'est le 2-hexanol ou l'hexan-2-à.
Si la structure est cyclique, il n'est pas nécessaire de placer un numérateur; Sauf s'il y a d'autres substituants. C'est pourquoi l'alcool cyclique de la deuxième image est appelé cyclohexanol (l'anneau est hexagonal).
Peut vous servir: aminesEt pour l'autre alcool de la même image (la ramifiée), son nom est: 6-éthyl-heptan-2 -ol.
Applications
-Sec-butanol est utilisé comme solvant et chimique intermédiaire. Il est présent dans les fluides hydrauliques pour les freins, les nettoyeurs industriels, le polissage, les épingles, les agents de flottation minérale et les fruits et les essences de parfum.
-L'alcool d'isopropanol est utilisé comme solvant industriel et comme anticoagulant. Il est utilisé dans les huiles et les encres à séchage rapide, comme l'antiseptique et le substitut de l'éthanol cosmétique (par exemple: lotions cutanées, tonique capillaire et alcool de friction).
-L'isopropanol est un ingrédient de savons liquides, de nettoyeurs de cristal, d'aromatiseurs synthétiques de boissons non alcoolisées et de nourriture. De plus, c'est un produit chimique intermédiaire.
-Le cyclohexanol est utilisé comme solvant, dans la finition tissulaire, dans la transformation du cuir et des savons émulsifiants et des détergents synthétiques.
-Le méthylciclohexanol est un ingrédient de produits à chewling basés sur du savon et des détergents pour les tissus spéciaux.
Exemples
2-octanol
 Molécule de 2-aranol. Source: Jü [domaine public], de Wikimedia Commons
Molécule de 2-aranol. Source: Jü [domaine public], de Wikimedia Commons C'est un alcool gras. C'est un liquide incolore, peu soluble dans l'eau, mais soluble dans la plupart des solvants non polaires. Il est utilisé, entre autres utilisations, dans l'élaboration des saveurs et des parfums, des peintures et des revêtements, des encres, des adhésifs, des soins domestiques et des lubrifiants.
Estradiol ou 17β-stradiol
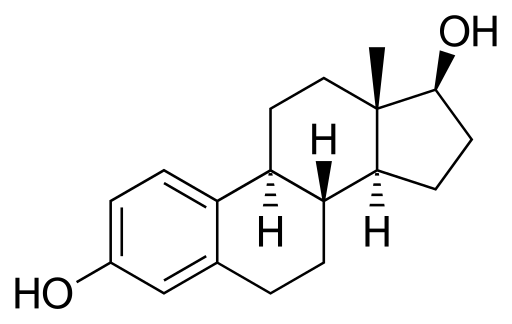 Molécule d'estradiol. Source: Neurotoger [domaine public], de Wikimedia Commons
Molécule d'estradiol. Source: Neurotoger [domaine public], de Wikimedia Commons C'est une hormone sexuelle stéroïde. Il a deux groupes hydroxillis dans sa structure. C'est l'oestrogène prédominant pendant les années de reproduction.
20-hydroxy-leukotriène
C'est un métabolite qui provient probablement de l'oxydation du lipide leucotriène. Il est classé comme un leucotriène cystinyle. Ces composés sont des médiateurs du processus inflammatoire qui contribue aux caractéristiques physiopathologiques de la rhinite allergique.
2-heptanol
C'est un alcool trouvé dans les fruits. De plus, il se trouve dans l'huile de gingembre et les fraises. Il est transparent, incolore et insoluble dans l'eau. Il est utilisé comme solvant de plusieurs résines et intervient dans la phase de flottaison dans le traitement des minéraux.
Les références
- Encyclopédie de la santé et de la sécurité au travail. (s.F.). Alcools. [PDF]. Récupéré de: Insht.est
- Structure et classification des alcools. CHIMISTER BOOLISTexts. Récupéré de: Chem.Bibliothèque.org
- « Tlachichinole ce qui est, caractéristiques, avantages, application
- Historique et signification du drapeau irakien »

