Alcool isopropylique

- 3832
- 203
- Adrien Remy
 Alcool isopropylique, couramment utilisé pour le nettoyage. Avec licence
Alcool isopropylique, couramment utilisé pour le nettoyage. Avec licence Qu'est-ce que l'alcool isopropylique?
Il alcool isopropylique soit Isopropanol C'est un composé organique dont la formule chimique est Cho3Chohch3 ou (ch3)2Choh. Il appartient à l'une des familles les plus importantes de la chimie organique: les alcools, comme son nom indique.
C'est un composé chimique chimique liquide, incolore, fort, volatile et inflammable. C'est un acide et une base faibles en même temps, similaires à l'eau, selon le pH de la solution et / ou la présence d'un acide ou d'une base plus forte qu'elle. Les vapeurs d'alcool isopropylique provoquent une irritation très légère dans le nez, la gorge et les yeux muqueux.
L'alcool isopropylique est utilisé comme principal ingrédient de divers produits de l'industrie pharmaceutique, chimique, commerciale et domestique. Pour ses propriétés antimicrobiennes, il est largement utilisé comme antiseptique sur la peau et les muqueuses, et comme désinfectant dans les matériaux inertes.
Il est très utile comme solvant, car il a une faible toxicité et est également utilisé comme additif à essence.
Il s'agit également de la matière première de la synthèse d'autres composés organiques en remplaçant le groupe fonctionnel hydroxyle (OH). De cette façon, cet alcool est très utile et polyvalent pour obtenir d'autres composés organiques, tels que les alcoxydes, les halogénures d'alkyle, entre autres composés chimiques.
Structure d'alcool isopropylique
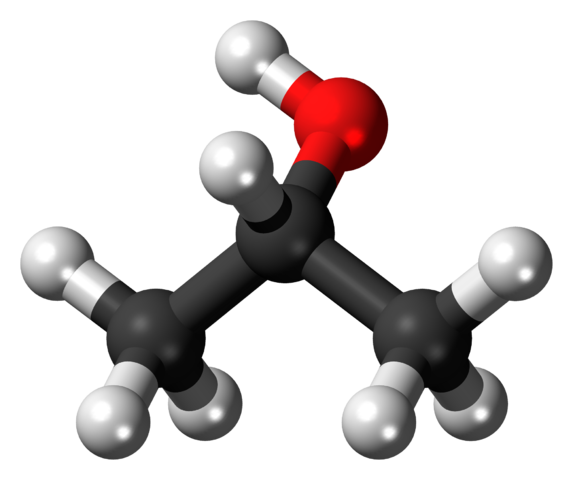 Schéma d'une molécule d'alcool isopropylique. Source: Jynto, Wikimedia Commons
Schéma d'une molécule d'alcool isopropylique. Source: Jynto, Wikimedia Commons L'image supérieure montre la structure de l'isopropyle ou de l'alcool isopropanol avec un modèle de sphères et de barres. Les trois sphères grises représentent les atomes de carbone, qui constituent le groupe isopropylique, attaché à un hydroxyle (sphères rouges et blancs).
- Comme tous les alcools, ils sont formés par un alcane, dans ce cas, le propane. Cela donne à l'alcool la caractéristique du lipophile (capacité à dissoudre les graisses étant donné leur affinité pour eux).
- Il est lié à un groupe hydroxyle (-OH), qui, d'autre part, donne à la structure la caractéristique hydrophile.
- L'alcool isopropylique peut dissoudre les graisses ou les taches. Notez que le groupe -OH est lié au carbone du milieu (2e, c'est-à-dire avec deux autres atomes de carbone), ce qui montre que ce composé est un alcool secondaire.
- Son point d'ébullition est inférieur à celui de l'eau (82,6 ° C), qui peut être expliqué du squelette de propane, qui peut à peine interagir les uns avec les autres à travers les forces de dispersion de Londres, plus bas par rapport aux ponts d'hydrogène (CH3)2Chou-h-o-ch (ch3)2.
Proprietes physiques et chimiques
- Poids moléculaire: 60,10 g / mol.
- Apparence physique: liquide et incolore et inflammable.
- Odeur forte.
- Point de fusion: -89 ° C.
- Point d'ébullition: 82,6 ° C.
- Densité: 0,786 g / ml à 20 ° C.
- Solubilité: il est soluble dans l'eau et soluble dans des composés organiques tels que le chloroforme, le benzène, l'éthanol, la glycérine, l'éther et l'acétone. Est insoluble dans les solutions salines.
- PKA: 17.
- Base conjuguée: (ch3)2Chou-
- Absorbance: l'alcool isopropylique dans le spectre ultraviolet visible a une absorbance maximale à 205 nm.
Nomenclature
Dans la nomenclature des composés organiques, il existe deux systèmes: celui des noms communs et le système IUPAC international.
L'alcool isopropylique correspond au nom commun, il se termine par le suffixe -ico, précédé du mot alcool et du nom du groupe de location. Le groupe de location se compose de 3 atomes de carbone, de deux extrémités méthyles et de celle du groupe -OH, c'est-à-dire du groupe isopropyle.
L'alcool isopropyle ou isopropanol a d'autres noms, tels que le 2-propanol, l'alcool-sec-propilique, entre autres, mais selon la nomenclature de l'IUPAC, elle est appelée propano-2-OC.
Selon cette nomenclature, elle est d'abord «propane» parce que la chaîne de carbone contient ou est formée par trois atomes de carbone. Deuxièmement, la position du groupe OH est indiquée dans la chaîne de carbone en utilisant un nombre, dans ce cas, elle est 2.
Le nom se termine par «ol», une caractéristique des composés organiques de la famille des alcools, pour contenir le groupe hydroxyle (-OH).
Le nom de l'isopropanol est considéré comme incorrect par l'IUPAC, en raison de l'absence d'hydrocarbures d'isopropano.
La synthèse
La réaction chimique de la synthèse d'alcool isopropylique au niveau industriel est essentiellement une réaction d'addition d'eau, c'est-à-dire l'hydratation.
Peut vous servir: acide phénoxyacétique: synthèse, procédure, utilisations, risquesLe produit de départ pour la synthèse ou l'obtention est le propeno, à laquelle l'eau est ajoutée. Le propeno ch3-Ch = ch2 C'est un alcène, des hydrocarbures dérivés de l'huile. Un hydrogène (H) est remplacé par l'hydratation par un groupe hydroxyle (OH).
L'eau est ajoutée à l'alcène Propeno en présence d'acides, pour produire de l'alcool d'isopropanol.
Il existe deux façons d'effectuer son hydratation: directe et indirecte, fabriquée dans des conditions polaires générant de l'isopropanol.
Ch3-Ch = ch2 (Propeno) => cho3Chohch3 (Isopropanol)
En hydratation directe, en phase gazeuse ou liquide, la propeno est hydratée par catalyse acide à haute pression.
Dans l'hydratation indirecte, la propeno réagit avec l'acide sulfurique, formant des esters de sulfate qui, par hydrolyse, produisent de l'alcool isopropylique.
L'alcool isopropylique est également obtenu par hydrogénation de l'acétone en phase liquide. Ces processus sont suivis d'une distillation pour séparer l'eau de l'eau, générant de l'alcool isopropylique anhydre avec un rendement d'environ 88%.
Applications
L'alcool isopropylique a une large gamme d'utilisations au niveau chimique. Il est utile pour développer d'autres composés chimiques. Il dispose de nombreuses applications au niveau industriel, pour le nettoyage des équipements, au niveau médical, dans les produits ménagers et l'utilisation esthétique.
Cet alcool est utilisé dans les parfums, les colorants capillaires, les laques, les savons, entre autres produits. Son utilisation est principale et fondamentalement externe, car son inhalation ou son ingestion pour les êtres vivants est très toxique.
- En bref: Vous pouvez obtenir des halogénures d'alkyle en remplaçant généralement le brome (BR) ou le chlore (CL), le groupe fonctionnel de l'alcool (OH). Effectuer un processus d'oxydation d'alcool isopropylique avec de l'acide chromique, l'acétone peut être donnée. Il peut former des alcoxydes à la suite de la réaction de l'alcool isopropylique avec certains métaux tels que le potassium.
- Pour le nettoyage: L'alcool isopropylique est idéal pour la propreté et l'entretien des cristaux optiques tels que les objectifs et l'équipement électronique, entre autres. Cet alcool s'évapore rapidement, ne laisse ni déchets ni traces et n'a aucune toxicité dans ses applications ou à usage externe.
- Antimicrobien: L'isopropanol a des propriétés antimicrobiennes, provoque la dénaturation des protéines bactériennes et dissout les lipoprotéines de la membrane cellulaire, entre autres effets. Comme l'antiseptique, l'alcool isopropylique est appliqué sur la peau et les muqueuses et s'évapore rapidement, laissant un effet de refroidissement. Il est utilisé pour effectuer des chirurgies mineures, une insertion d'aiguille, des cathéters, entre autres procédures invasives. De plus, il est utilisé comme désinfectant des instruments médicaux.
- Médecine: Outre son utilisation comme antimicrobien, il est nécessaire dans les laboratoires pour le nettoyage, la conservation des échantillons et l'extraction d'ADN. Cet alcool est très utile dans le développement de produits pharmacologiques. L'alcool isopropylique est mélangé avec des parfums et des huiles essentiels, et est utilisé dans des composés thérapeutiques pour frotter sur le corps.
- Solvant: L'alcool isopropile a la propriété de dissoudre certaines huiles, résines naturelles, gencives, alcaloïdes, éthylcelulose, entre autres composés chimiques.
Les références
- ALCOOL ISOPROPYLIQUE. Récupéré de pubchem.NCBI.NLM.NIH.Gouvernement.
- ALCOOL ISOPROPYLIQUE. Récupéré de Britannica.com.

